
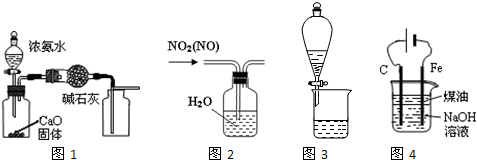
| A、用图1装置制取并收集干燥纯净的NH3 |
| B、用图2所示装置可除去NO2中的NO |
| C、用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D、用图4装置制备Fe(OH)2并能较长时间观察其颜色 |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5um(10-6m)的颗粒物,因此均能形成胶体 |
| B、研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染 |
| C、PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性 |
| D、工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液①中,c(CH3COO-)=c(H+) |
| B、溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) |
| C、溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、③⑤⑥⑩ |
| C、②④⑥⑦ | D、③④⑤⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配 料 | 氯化钠、碘酸钾、抗结剂 |
| 净含量 | 500g |
| 碘含量 | 20~30mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com