
分析 (1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的;
(3)反应①中I-失去电子生成I2,共升高2价,SeO2中+4价Se得到单质还原为单质Se,共降低4价,化合价升降最小公倍数为4,进而确定各物质的量的系数配平方程式,确定转移电子数目,标出电子转移的方向和数目;
(4)根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=cV计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=nM计算SeO2的质量,进而计算样品中SeO2的质量分数.
解答 解:(1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为$\frac{1×3+1×1}{4}$=1,故反应方程式为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑,
故答案为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2,故答案为:H2SO4(浓)>SeO2>SO2;
(3)反应①中I-失去电子生成I2,共升高2价,SeO2中+4价Se得到单质还原为单质Se,共降低4价,化合价升降最小公倍数为4,故KI的系数为4,I2的系数为2,SeO2、Se的系数都是1,KNO3的系数为4,H2O的系数为2,配平并标出电子转移的方向和数目为: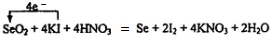 ,
,
故答案为:1,4,4,1,2,4,2;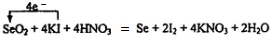 ;
;
(4)根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.025L=0.005mol,
根据关系式计算样品中n(SeO2)=0.005mol×$\frac{1}{4}$=0.00125mol,
故SeO2的质量为0.00125mol×111g/mol=0.13875g,
所以样品中SeO2的质量分数为:$\frac{0.13875g}{0.1500g}$×100%=92.50%,
故答案为:92.50%.
点评 本题考查氧化还原反应有关知识,涉及氧化性强弱比较、氧化还原反应配平、电子转移表示、氧化还原反应滴定计算等,难度中等,注意(4)中根据关系式的计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 胶体是一种介稳性的分散系,其粒子能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | SO42- | C. | OH- | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
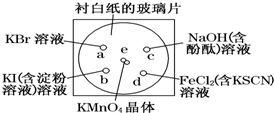 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com