
已知NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4 L O2和O3组成的混合物中原子总数为2NA
B.1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA
C.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
D.1 mol重甲基(-CD3)含有电子数为9NA
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
针对下图装置的说法中,正确是
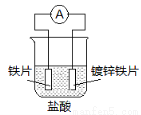
A.溶液中pH值明显下降
B.铁片为正极,镀锌铁片为负极
C.阴极的电极反应式:Fe-2e→Fe2+
D.电子由锌经溶液流向铁
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
|
| ① | ② |
| ③ |
|
三 |
| ④ | ⑤ | ⑥ |
|
| ⑦ | ⑧ |
四 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)在这些元素中,⑩原子的原子结构示意图为 。
(2)写出①的最高价氧化物和②的单质的电子式 , 。
(3)用电子式表示③与④形成化合物的过程 。
(4)①的单质和⑥的氧化物反应的化学方程式 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于下图所示原电池装置的叙述中,正确的是
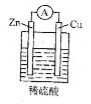
A.铜片是负极
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)以下是一些物质的熔沸点数据(常压):
| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4Na(g)+3CO2(g) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
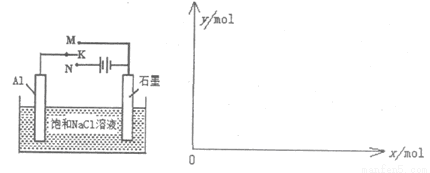
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:填空题
(14分)工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):
Ph—CH2CH3(g) Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如下图a、b所示。
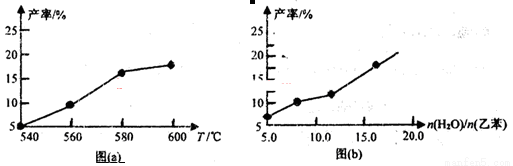
(1)根据反应及上图(a),判断△H 0(填“<”“=”或“>”,下同),△S 0;请选择经济、且适宜的反应温度: 。
(2)下列事实可以说明该反应已达平衡的是 。
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用 的生产条件。实际工业生产中常采用通入水蒸气的方法。水蒸气的含量对反应的影响结果如上图(b)所示。
①在做这四组实验时,应该采用的其他实验条件是 。
A.反应温度相同 B.采用不同的催化剂
C.压强都控制在常压下 D.反应相同时间时测定实验数据
②图(b)表明: 。
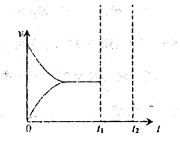
③一定温度下,在恒压密闭容器中,通入一定量n(H2O)/n(乙苯)=7:1的气体,发生上述反应,在t1时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在t2时刻重新达到平衡,请在右图中画如反应再次达到平衡过程的图像。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:选择题
下列图示实验现象及其解释不正确的是( )
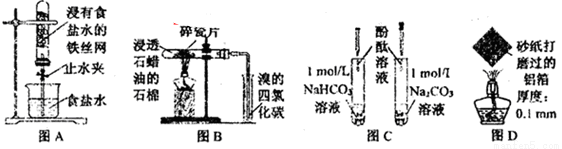
A.图A,一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀
B.图B,加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生
C.图C,溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32-
D.图D,加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三年级总复习质量检测三理综化学试卷(解析版) 题型:选择题
某充电电池的原理如图所示,溶液中c(H+)=2.0 mol ,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
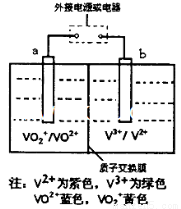
A.放电过程中,左槽溶液颜色由黄色变为蓝色
B.充电时,b极接直流电源正极,a极接直流电源负极
C.充电过程中,a极的反应式为: VO2++2H++e-= VO2++H2O
D.放电时,H+从左槽迁移进右槽
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:填空题
Ⅰ、有下列五种烃:① 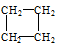 ②
② 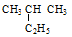 ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤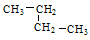 ,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,
,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,
② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是 (填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
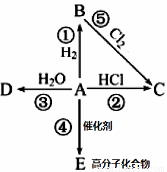
(1)写出A的电子式 ,E的结构简式为
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com