
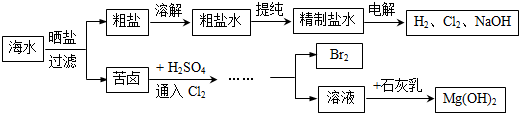


| ||
| ||
| ||
| ||


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3- |
| B、Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O |
| C、向NH4HCO3溶液中加入足量NaOH溶液并加热:HCO3-+NH4++2OH-=NH3↑+2H2O+CO32- |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
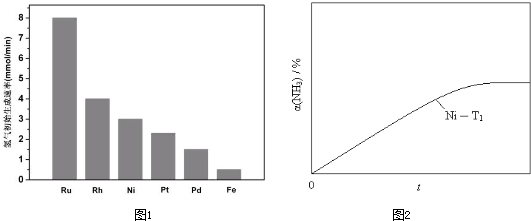
查看答案和解析>>
科目:高中化学 来源: 题型:
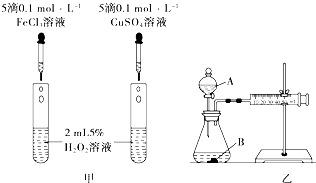 Ⅰ.为比较Fe3+和Cu2+对H2O2分解的催化效果,两组同学分别设计了如图甲、图乙所示的实验.
Ⅰ.为比较Fe3+和Cu2+对H2O2分解的催化效果,两组同学分别设计了如图甲、图乙所示的实验.| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=4.0×10-3mol/(L?min) |
| B、其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) |
| C、该温度下此反应的平衡常数K=1.44 |
| D、其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与足量的溴水反应 |
| B、与足量的溴蒸气反应 |
| C、分别进行燃烧 |
| D、在一定条件下通入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
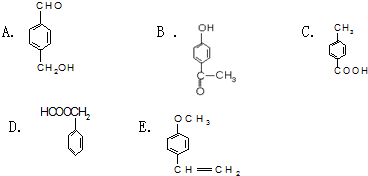
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com