
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是 ( )。
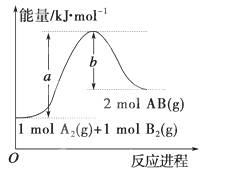
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量[来源:Z,xx,k.Com]
科目:高中化学 来源: 题型:
关于图中各装置的叙述不正确的是

A. 装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 装置②能测量锌与硫酸的反应速率
C. 装置③能验证铁的吸氧腐蚀
D. 装置④的X电极是负极,则能验证外接电源的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表的一部分,在这11中元素中,按要求完成各小题。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑾ | |||
| 4 | ② | ④ | ⑩ |
(1) 化学性质最不活泼的元素 ,(填元素符号,下同),非金属性最强的元素是 。
金属性最强的单质与水反应的离子方程式为
(2)①③⑤三种元素的原子半径由大到小的顺序为 (填元素符号);这三种元素的最高价氧化物水化物中,碱性最强的 (填化学式)。
(3)⑧⑨⑩三种元素的原子半径由大到小的顺序为 (填元素符号)。
这三种元素的氢化物中,稳定性最强的 (填化学式)。
(4)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高
价氧化物和盐酸反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E 的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.工业上常用电解法制备元素C、D、E的单质
B.化合物AE和CE含有相同类型的化学键
C.元素A、B组成的化合物常温下一定呈气态
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以戊烷(C5H12)为汽油代表,这个电池正极发生的电极反应方程式是O2 + 4e- = 2O2-,负极发生的反应方程式是: ;固体电解质里O2-向 极移动;
(2)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是 ;
Ⅱ.为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为VL,V等于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 076.7 kJ/mol
D.N2H4(g)+ N2O4(g)===
N2O4(g)=== N2(g)+2H2O(g)
N2(g)+2H2O(g)
ΔH=-1 076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应2SO2(g)+O2(g)  2SO3(g)(正反应为放热反应),下列有关说法正确的是( )
2SO3(g)(正反应为放热反应),下列有关说法正确的是( )
A.升高温度正反应加快,逆反应不变 B.升高温度正逆反应都加快
C.升高温度逆反应加快,正反应不变 D.升高温度逆反应加快,正反应减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于强弱电解质的说法中,正确的是( )
A.MgO在熔化状态下全部电离,是弱电解质
B.具有极性键的共价化合物都是强电解质
C.具有非极性键的共价化合物都是弱电解质
D.所有弱酸、弱碱都是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为
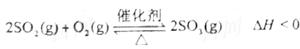
B.海水提镁的主要步骤为

C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com