
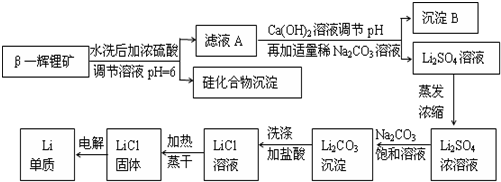
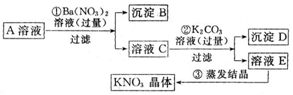
分析 本题是工业上用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧化钙和碳酸钠溶液除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂,再将溶液中锂离子转化为溶解度较小碳酸锂,加饱和Na2CO3溶液的目的是使Li+转化生成Li2CO3沉淀,通过恰当方法最终得到单质锂.
(1)LiAlSi2O6与硫酸反应,LiAlSi2O6可表示为:Li2O•Al2O3•4SiO2,依据氧化物的性质和硫酸发生的反应写出;
(2)用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧化钙和碳酸钠溶液,除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂;
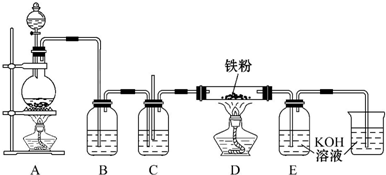
(3)使用的硅酸盐质仪器是指玻璃仪器;
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是增大锂离子的浓度,在加入碳酸钠溶液后生成碳酸锂沉淀;
(5)氢氟酸与玻璃中的二氧化硅发生反应;
(6)依据密度和质量的关系计算LiH的体积,结合氢气体积计算比值.
解答 解(1)LiAlSi2O6与硫酸反应,LiAlSi2O6可表示为:Li2O•Al2O3•4SiO2,由氧化物与硫酸的反应定量关系以及流程图中生成硅化合物沉淀可知反应的化学方程式为2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓,
故答案为:2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓;
(2)用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧根和碳酸钠溶液,除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂,所以B沉淀为Al(OH)3、Mg(OH)2、CaCO3,由于Mg(OH)2很少量,因此主要成分是Al(OH)3、CaCO3;
故答案为:Al(OH)3、CaCO3;
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、玻璃棒、酒精灯,
故答案为:酒精灯;玻璃棒;
(4)碳酸锂微溶于水,上述生产流程中蒸发浓缩Li2SO4溶液的目的是增大锂离子的浓度,在加入碳酸钠溶液后,使锂离子浓度与碳酸根离子浓度之积大于Ksp,生成碳酸锂沉淀,
故答案为:碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li2CO3),以便产生碳酸锂沉淀;
(5)用普通的玻璃仪器或陶瓷仪器,会和氢氟酸发生反应生成四氟化硅和水,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(6)由反应I,当吸收224LH2(10mol)时,则生成20molLiH,V=$\frac{m}{p}$=$\frac{20mol×8g/mol}{0.82×1{0}^{3}g/L}$=195.1×10-3L,$\frac{V(LiH)}{V({H}_{2})}$=$\frac{195.1×1{0}^{-3}}{224L}$═1:1148,
故答案为:1148.
点评 本题主要考查物质的分离、电解原理、盐类的水解等,难度难度较大,掌握实验的原理和流程分析是解题的关键.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出碱液的滴定管开始有气泡,发出液体后气泡消失 | |
| B. | 滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 | |
| C. | 锥形瓶用蒸馏水洗涤后,直接加入待测溶液滴定 | |
| D. | 滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com