
| A. | 乳酸薄荷醇酯(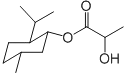 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛(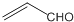 )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,核磁共振氢谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用核磁共振氢谱鉴别 |
分析 A.乳酸薄荷醇酯中含有羟基,能够发生取代反应;
B.关键乙醛和丙烯醛的结构及二者与氢气反应产物判断是否属于同系物;
C.聚乙烯和苯分子中不含碳碳双键;
D.二者含有的氢原子的种类、相应的数目相同,但是各种氢原子的具体位置不同,可以用核磁共振氢谱来鉴别.
解答 解:A.乳酸薄荷醇酯( )中含有酯基、羟基,能够发生水解、氧化、消去反应,还能够发生取代反应(H氢原子被卤素原子确定),故A错误;
)中含有酯基、羟基,能够发生水解、氧化、消去反应,还能够发生取代反应(H氢原子被卤素原子确定),故A错误;
B.乙醛和丙烯醛( )的结构不同,所以二者一定不是同系物;它们与氢气充分反应后分别生成乙醇和丙醇,所以与氢气加成的产物属于同系物,故B正确;
)的结构不同,所以二者一定不是同系物;它们与氢气充分反应后分别生成乙醇和丙醇,所以与氢气加成的产物属于同系物,故B正确;
C.聚乙烯和苯分子中不含碳碳双键,故C错误;
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,核磁共振氢谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,但是二者的核磁共振氢谱中峰的位置不相同,可以用核磁共振氢谱来鉴别,故D错误.
故选B.
点评 本题考查了常见有机物的结构与性质、核磁共振氢谱的应用、同系物的判断,题目难度中等,注意掌握常见有机物的结构与性质,明确核磁共振氢谱表示的意义及同系物的概念.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
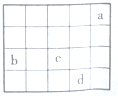
| A. | 四种元素中,d单质的化学性质最稳定 | |
| B. | 气态氢化物的还原性:d>c | |
| C. | 原子半径:b<c | |
| D. | b元素最高价氧化物可形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
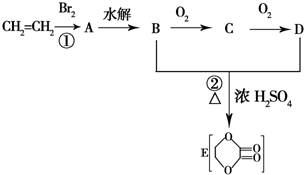 由乙烯和其他无机原料合成环状 化合物其合成过程如图(水及其他无机产物均已省略):
由乙烯和其他无机原料合成环状 化合物其合成过程如图(水及其他无机产物均已省略):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,工业上扁桃酸可以由烃A经过以下步骤合成得到:
,工业上扁桃酸可以由烃A经过以下步骤合成得到: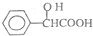
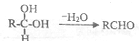
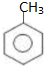 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
.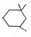 )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
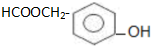 .
.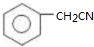 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸(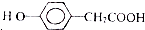 )的合理路线.
)的合理路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com