
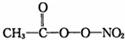 (PAN)等二次污染物.
(PAN)等二次污染物.分析 (1)As原子核外电子数为33,根据能量最低原理书写核外电子排布式;
(2)Fe3+含有空轨道,CN-含有孤对电子,Fe3+与CN-之间形成配位键;原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)①N2O中N原子形成2个σ键、没有孤对电子,杂化轨道数目为2;
单键为σ键,双键含有1个σ键、1个π键,PAN分子中σ键数目为10;
②Kr晶体为面心立方晶体,以顶点Kr原子研究,与之相邻的Kr原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,利用均摊法计算晶胞中Kr原子数目、晶胞中Kr原子配位数,结合晶胞中含有Kr原子数目,表示出晶胞质量,再结合m=ρV计算晶胞棱长.
解答 解:(1)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)Fe3+含有空轨道,CN-含有孤对电子,二者之间形成配位键;原子数目相等、价电子数目相等的微粒互为等电子体,与CN-互为等电子体的化合物分子式为CO,
故答案为:配位;CO;
(3)①N2O结构式可表示为N=N=O,N2O中中心氮原子形成2个σ键、没有孤对电子,杂化轨道数目为2,N原子采取sp杂化;单键为σ键,双键含有1个σ键、1个π键,PAN分子中σ键数目为10,则l mol PAN中含σ键数目为10NA,
故答案为:sp;10NA;
②Kr晶体为面心立方晶体,以定点Kr原子研究,与之相邻的Kr原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,晶体中与每个Kr原子相紧邻的Kr原子数为$\frac{3×8}{2}$=12,晶胞中Kr原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则$\frac{m}{n}$=3;
晶胞质量为4×$\frac{M}{{N}_{A}}$g,晶体的密度为ρg/cm3,则ρg/cm3×(a×10-7 cm)3=4×$\frac{M}{{N}_{A}}$g,解得a=$\root{3}{\frac{4M}{ρ{N}_{A}}}$×10-7,
故答案为:3;$\root{3}{\frac{4M}{ρ{N}_{A}}}$×10-7.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、等电子体、杂化方式、化学键、晶胞计算等,是对物质结构主干知识考查,(3)中计算为易错点,需要学生具备一定的空间想象,理解掌握用均摊法进行晶胞有关计算.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | SrO可与盐酸反应 | B. | Sr(OH)2难溶于水 | C. | SrSO4难溶于水 | D. | Sr(OH)2是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 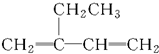 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3 1-丁烯 | ||
| C. | 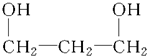 1,3-二丙醇 1,3-二丙醇 | D. | 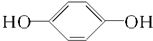 1,4-苯二酚 1,4-苯二酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
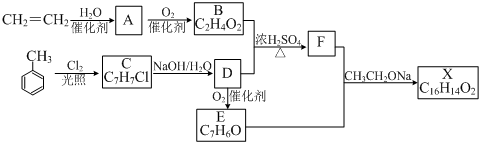
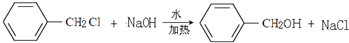 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.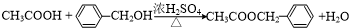 .
.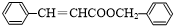 .
.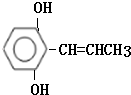 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
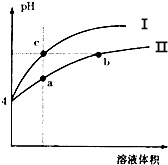
| A. | Ⅰ为氯化铵溶液稀释时pH值变化曲线 | |
| B. | b点比c点溶液的导电能力强 | |
| C. | a点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| D. | b点比a点溶液中的水的电离程度大,但两点的KW相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(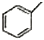 )的一氯代物 )的一氯代物 | D. | 立体烷(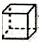 )的二氯代物 )的二氯代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com