
【题目】根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 连接仪器、________、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_______。装置A中试剂是_______。
③ 能说明碳的非金属性比硅强的实验现象是_________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是____。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ____ | ____ |
写出其中SO2显示还原性生成沉淀的离子方程式_________。
【答案】检验装置气密性 Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O KMnO4溶液 A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀 2H2S+SO2=3S↓+2H2O BaSO4 BaSO3 Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-
CuSO4 + SO2↑+ 2H2O KMnO4溶液 A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀 2H2S+SO2=3S↓+2H2O BaSO4 BaSO3 Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-
【解析】
(1)①验证碳、硅非金属性的相对强弱,是通过碳酸和可溶性硅酸盐反应析出硅酸沉淀实现的,所以为了保证实验效果和实验的顺利进行,须检查装置的气密性;
②铜与浓硫酸反应,铜被氧化成+2价的铜离子,硫酸被还原成+4价的二氧化硫;高锰酸钾有强氧化性,能氧化二氧化硫;
③当A中KMnO4溶液没有完全褪色,说明二氧化硫已经完全除尽,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强;
(2)②二氧化硫中硫元素的化合价是+4价,被硫化氢中-2价的硫还原;
③氯气具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀。
(1)①为了保证实验的顺利进行,避免装入药品后发现装置气密性不好,更换部分仪器而浪费药品,避免装置漏气影响实验效果,所以连接仪器后须检查装置气密性;
②铜和热的浓硫酸反应,反应中Cu元素的化合价由0升高到+2价,作还原剂,产物为二氧化硫、硫酸铜和水,反应的方程式为Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O ;高锰酸钾有氧化性,二氧化硫和高锰酸钾能发生氧化还原反应;
CuSO4 + SO2↑+ 2H2O ;高锰酸钾有氧化性,二氧化硫和高锰酸钾能发生氧化还原反应;
③二氧化硫中硫元素的化合价是+4价,属于中间价态,既有氧化性又有还原性,高锰酸钾有强氧化性,离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+,当A中KMnO4溶液没有完全褪色,说明二氧化硫已经完全除尽,避免了二氧化硫和可溶性硅酸盐反应,二氧化碳和水反应生成碳酸,碳酸和可溶性硅酸盐反应析出硅酸白色沉淀,说明碳酸能制取硅酸,能证明碳酸酸性强于硅酸酸性;
(2)②二氧化硫中硫元素的化合价是+4价,有氧化性,二氧化硫气体与H2S溶液常温下反应,生成黄色固体硫(单质)和水,反应的化学方程式为2H2S + SO2 = 3S↓ + 2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成BaSO4白色沉淀,反应的方程式为Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成BaSO3沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是可逆反应 A + 2B![]() 2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
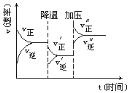
A.若 A、B 是气体,则 D 是液体或固体
B.A、B、C、D均为气体
C.逆反应是放热反应
D.达平衡后,v(A)正 = 2v(C)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再缓慢通入HCl气体6.72L(标准状况),若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中溶质为NaCl和NaOH
C.最终得到7.8g的沉淀
D.最终得到的溶液中NaCl的物质的量浓度为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
(2)已知在400 ℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)________(填“>”“<”“=”或“不能确定”)v逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________(填“向左”“向右”或“不”)移动;使用催化剂________(填“增大”“减小”或“不改变”)反应的ΔH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
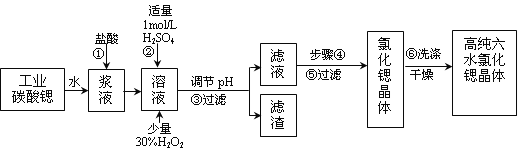
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和____________________(写一种)。碳酸锶与盐酸反应的离子方程式________________________________。
(2)在步骤②~③的过程中,将溶液的pH值由1调节至_______;宜用的试剂为_______。
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是_______________________(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是_______。
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中放入一定量的NO2,发生反应2NO2(g)![]() N2O4(g) △H<0,在达平衡后,若分别单独改变下列条件,重新达到平衡后,有可能使平衡混合气体平均相对分子质量减小的是
N2O4(g) △H<0,在达平衡后,若分别单独改变下列条件,重新达到平衡后,有可能使平衡混合气体平均相对分子质量减小的是
A.通入NO2B.通入N2O4C.通入N2D.降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含烃类、CO、NO与SO2等),是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)= N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1、ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法能用平衡移动原理解释的是
A.在电解水实验中,加入硫酸钠可以提高电解效率
B.碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成
C.在一定温度下某容器内发生下列反应:I2(g)+H2(g) ![]() 2HI(g) △H<0,缩小容器的体积,混合气体颜色加深
2HI(g) △H<0,缩小容器的体积,混合气体颜色加深
D.在双氧水中加FeCl3溶液可使产生O2速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com