
”¾ĢāÄæ”放»Æѧ”ŖŃ”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ”æ
īѱ»³ĘĪŖ¼ĢĢś”¢ĀĮÖ®ŗóµÄµŚČż½šŹō£¬Öʱø½šŹōīѵÄŅ»ÖÖĮ÷³ĢČēĻĀ£ŗ

»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©»łĢ¬īŃŌ×ӵļŪµē×ÓÅŲ¼Ķ¼ĪŖ £¬ĘäŌ×ÓŗĖĶā¹²ÓŠ ÖÖŌĖ¶ÆדĢ¬²»ĻąĶ¬µÄµē×Ó”£½šŹōīŃ¾§°ūČēĻĀĶ¼1ĖłŹ¾£¬ĪŖ ¶Ń»ż£ØĢī¶Ń»ż·½Ź½£©”£
£Ø2£©øł¾Ż¼Ū²ćµē×Ó»„³āĄķĀŪ£¬¼Ū²ćµē×Ó¶ŌÖ®¼äµÄ³āĮ¦“óŠ”ÓŠČēĻĀĖ³Šņ£ŗl£l >> l£b > b£b£ØlĪŖ¹Ā¶Ōµē×Ó¶Ō£¬bĪŖ¼üŗĻµē×Ó¶Ō£©£¬Ōņ¹ŲÓŚH2OÖŠµÄH£O£H¼ü½ĒæÉµĆ³öµÄ½įĀŪŹĒ________”£
A£®180”ć | B£®½Ó½ü120”ć£¬µ«Š”ÓŚ120”ć |
C£®½Ó½ü120”ć£¬µ«“óÓŚ120”ć | D£®½Ó½ü109”ć28”Æ£¬µ«Š”ÓŚ109”ć28”Æ |
£Ø3£©ŅŃÖŖTiCl4ŌŚĶس£ĒéæöĻĀŹĒĪŽÉ«ŅŗĢ壬ČŪµćĪŖØC37”ę£¬·ŠµćĪŖ136”ę£¬æÉÖŖTiCl4ĪŖ________¾§Ģ唣
£Ø4£©ÄÉĆ×TiO2ŹĒŅ»ÖÖÓ¦ÓĆ¹ć·ŗµÄ“߻ƼĮ£¬Ęä“߻ƵÄŅ»øöŹµĄżČēĻĀĶ¼2”£»ÆŗĻĪļŅŅµÄ·ŠµćĆ÷ĻŌøßÓŚ»ÆŗĻĪļ¼×£¬Ö÷ŅŖŌŅņŹĒ ”£»ÆŗĻĪļŅŅÖŠ²ÉČ”sp3ŌӻƵÄŌ×ӵĵŚŅ»µēĄėÄÜÓɓ󵽊”µÄĖ³ŠņĪŖ ”£

£Ø5£©øĘīŃæó¾§ĢåµÄ½į¹¹ČēÓŅĶ¼ĖłŹ¾”£īŃĄė×ÓĪ»ÓŚĮ¢·½¾§°ūµÄ½Ē¶„£¬±» øöŃõĄė×Ó°üĪ§³ÉÅäĪ»°ĖĆęĢ壻øĘĄė×ÓĪ»ÓŚĮ¢·½¾§°ūµÄĢåŠÄ£¬±» øöŃõĄė×Ó°üĪ§”£øĘīŃæó¾§ĢåµÄ»ÆѧŹ½ĪŖ ”£ČōøĆ¾§°ūµÄ±ß³¤ĪŖa pm£¬ŌņøĘīŃæó¾§ĢåµÄĆܶČĪŖ g.cm-3£ØÖ»ŅŖĒóĮŠĖćŹ½£¬²»±Ų¼ĘĖć³öŹżÖµ£©”£

”¾“š°ø”æ£Ø1£©![]() 22 Įł·½×īĆÜ£Ø2£©D
22 Įł·½×īĆÜ£Ø2£©D
£Ø3£©·Ö×Ó£Ø4£©»ÆŗĻĪļŅŅ·Ö×Ó¼äŠĪ³ÉĒā¼ü N£¾O£¾C
£Ø5£©6 12 CaTiO3![]()
”¾½āĪö”æŹŌĢā·ÖĪö£ŗ£Ø1£©ĢåŠÄ½į¹¹ĪŖĮł·½×īĆܶѻż”££Ø2£©H2OÖŠOµÄŌӻƷ½Ź½ĪŖsp3Ōӻƣ¬¼ü½Ē½Ó½ü109”ć28”Æ Ņņ l£l>>l£b>b£bŹ¹ŃõŌ×ÓÖÜĪ§µē×ÓŌĘĆÜ¶Č¼õŠ”£¬¹ŹŠ”ÓŚ109”ć28”Æ”££Ø3£©·Ö×Ó¾§ĢåČŪ·Šµć½ĻŠ””££Ø4£©»ÆŗĻĪļŅŅÖŠµÄŃĒ°±»łČŻŅ׊Ī³É·Ö×ÓÄŚĒā¼ü£¬ŹĒ»ÆŗĻĪļ·ŠµćÉżøß”£N£¬O£¬CŹĒsp3Ōӻƣ¬Ķ¬ÖÜĘŚµŚŅ»µēĄėÄÜ“Ó×óµ½ÓŅŅĄ“ĪŌö“󣬵«ŅņNŌ×ÓĪŖ°ė³äĀśµÄĪČ¶Ø½į¹¹£¬¹ŹN£¾O£¾C”££Ø5£©ÓÉĶ¼æÉÖŖ£¬īŃĄė×Ó±»°ĖĆęĢåĢåµÄĮłøöŃõĄė×Ó°üĪ§”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆÓŚ¹Ū²ģŗĖĖįŌŚĻø°ūÖŠ·Ö²¼µÄŹŌ¼ĮŹĒ
A. ģ³ĮÖŹŌ¼Į B. Ė«ĖõėåŹŌ¼Į
C. ĖÕµ¤¢óČ¾Ņŗ D. ßĮĀŽŗģ”¢¼×»łĀĢČ¾É«¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖŃŠ¾æĶÓėÅØĮņĖįµÄ·“Ó¦£¬Ä³»ÆѧŠĖȤŠ”×é½ųŠŠČēĻĀŹµŃ飮
ŹµŃéI£ŗ·“Ó¦²śĪļµÄ¶ØŠŌĢ½¾æ£¬°“ČēĶ¼×°ÖĆ£Ø¹Ģ¶Ø×°ÖĆŅŃĀŌČ„£©½ųŠŠŹµŃé

(1)A×°ÖƵďŌ¹ÜÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_____________________£»F×°ÖƵÄÉÕ±ÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ__________________________£»B×°ÖĆÖŠµÄĻÖĻóŹĒ_________”£
(2)ŹµŃé¹ż³ĢÖŠ£¬ÄÜÖ¤Ć÷ÅØĮņĖįÖŠĮņŌŖĖŲµÄŃõ»ÆŠŌĒæÓŚĒāŌŖĖŲµÄĻÖĻóŹĒ______________ ”£
(3)ŹµŃé½įŹųŹ±£¬³·Č„ĖłÓŠ¾Ę¾«µĘÖ®Ē°±ŲŠėĶź³ÉµÄŹµŃé²Ł×÷ŹĒ_________________”£
(4)ŹµŃé½įŹųŗó£¬Ö¤Ć÷A×°ÖĆŹŌ¹ÜÖŠ·“Ó¦ĖłµĆ²śĪļŹĒ·ńŗ¬ÓŠĶĄė×Ó£¬Šč½«ČÜŅŗĻ”ŹĶ£¬²Ł×÷·½·ØŹĒ________________________________”£
ŹµŃé¢ņ£ŗ·“Ó¦²śĪļµÄ¶ØĮæĢ½¾æ
(5)ŌŚĶÓėÅØĮņĖį·“Ó¦µÄ¹ż³ĢÖŠ£¬·¢ĻÖÓŠŗŚÉ«ĪļÖŹ³öĻÖ£¬ĒŅŗŚÉ«ĪļÖŹĪŖCu2S”£²śÉśCu2SµÄ·“Ó¦ĪŖaCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O£¬Ōņa£ŗb=______________”£
cCu2S+dCuSO4+e H2O£¬Ōņa£ŗb=______________”£
(6)ĪŖ²ā¶ØĮņĖįĶµÄ²śĀŹ£¬½«øĆ·“Ó¦ĖłµĆČÜŅŗÖŠŗĶŗóÅäÖĘ³É250.00mLČÜŅŗ£¬Č”øĆČÜŅŗ25.00mL¼ÓČė×ćĮæKIČÜŅŗÖŠÕńµ“£¬Éś³ÉµÄI2Ē”ŗĆÓė20.00mL 0.30molL©1µÄNa2S2O3ČÜŅŗ·“Ó¦£¬Čō·“Ó¦ĻūŗÄĶµÄÖŹĮæĪŖ6.4g£¬ŌņĮņĖįĶµÄ²śĀŹĪŖ_________________”££ØŅŃÖŖ2Cu2++4I©=2CuI+I2£¬ 2S2O32©+I2=S4O62©+2I©£© ”¾×¢£ŗĮņĖįĶµÄ²śĀŹÖøµÄŹĒĮņĖįĶµÄŹµ¼Ź²śĮæÓėĄķĀŪ²śĮæµÄ±ČÖµ”æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŖæŖ·¢ŠĀŠĶ“߻ƼĮ²ÄĮĻæÉŅŌ“ÓŌŖĖŲÖÜĘŚ±ķµÄÄÄæéĒųÓņŃ°ÕŅ
A.Ö÷×åŌŖĖŲB.ø±×åŌŖĖŲ
C.¢ńA×åD.½šŹō·Ē½šŹō·Ö½ēĻßø½½ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”ææɳäµē”°ÄĘ”¤¶žŃõ»ÆĢ¼”±µē³Ų£ØČēĶ¼£©£¬µē³Ų×Ü·“Ó¦ĪŖ£ŗ4Na+3CO2![]() 2Na2CO3+C”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
2Na2CO3+C”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

A. ·ÅµēŹ±£¬Na+ĻņÕż¼«ŅʶÆ
B. ·ÅµēŹ±£¬µē×Ó“ÓÄʱ”¾øŗŌŲĮ÷Ļņ¶ą±ŚÄÉĆ×Ģ¼¹Ü
C. ³äµēŹ±£¬Äʱ”ŗĶĶā½ÓµēŌ“µÄøŗ¼«ĻąĮ¬£¬·¢ÉśŃõ»Æ·“Ó¦
D. ³äµēŹ±£¬Ńō¼«µÄµē¼«·“Ó¦ĪŖ£ŗ2Na2CO3£«C£4e-£½4Na+£«3CO2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijӊ»śøß·Ö×ÓŗĻ³É²ÄĮĻKµÄŗĻ³ÉĀ·ĻßČēĻĀĶ¼(²æ·Ö·“Ó¦Ģõ¼žŗĶ²śĪļĀŌČ„)ĖłŹ¾”£

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ŅŃÖŖ£ŗ

(1)AŹĒĻą¶Ō·Ö×ÓÖŹĮæĪŖ92µÄ·¼ĻćĢž£¬ŌņAµÄ·Ö×ÓŹ½ĪŖ_____________£¬G”śHµÄ·“Ó¦ĄąŠĶĪŖ__________________”£
(2)¼ģŃéEÖŠŗ¬Ńõ¹ŁÄÜĶÅµÄŹŌ¼ĮĪŖ_________________(ĢīĆū³Ę)”£
(3)·ūŗĻĻĀĮŠĢõ¼žµÄÓŠ»śĪļFµÄĶ¬·ÖŅģ¹¹ĢåÓŠ________ÖÖ(²»æ¼ĀĒĖ³·“Ņģ¹¹)£»ĘäÖŠŗĖ“Ź²ÕńĒāĘ×ÖŠÓŠ5×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ3£ŗ2£ŗ2£ŗ2£ŗ1µÄŹĒ_________________(Š“½į¹¹¼ņŹ½)”£
¢ŁÓöFeCl3ČÜŅŗĻŌ×ĻÉ«£»
¢ŚÄÜÓėäåĖ®·¢Éś¼Ó³É·“Ó¦£»
¢ŪŹōÓŚ·¼Ļć»ÆŗĻĪļ”£
(4)Š“³öFŗĶJ·“Ӧɜ³ÉKµÄ»Æѧ·½³ĢŹ½__________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖ½ńĢ«ŃōÄܹā·ü²śŅµÅī²Ŗ·¢Õ¹£¬ĶʶÆĮĖøß“æ¹čµÄÉś²śÓėÓ¦ÓĆ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ń£®¹¤ŅµÉĻÓĆ”°Ī÷ĆÅ×Ó·Ø”±ŅŌ¹čŹÆ£ØSiO2£©ĪŖŌĮĻÖʱøŅ±½š¼¶øß“æ¹čµÄ¹¤ŅÕĮ÷³ĢČēĻĀĶ¼ĖłŹ¾£ŗ

¼ŗÖŖ£ŗSiHCl3 ŹŅĪĀĻĀĪŖŅ×»Ó·¢”¢Ņ×Ė®½āµÄĪŽÉ«ŅŗĢ唣
£Ø1£©”°»¹Ō”±¹ż³ĢŠčŅŖŌŚøßĪĀĢõ¼žĻĀ£¬øĆ·“Ó¦µÄÖ÷ŅŖ»¹Ō²śĪļĪŖ_____________”£
£Ø2£©”°Ńõ»Æ”±¹ż³Ģ·“Ó¦ĪĀ¶ČĪŖ200”«300”ę£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__________”£
£Ø3£©”°Ńõ»Æ”±”¢”°·ÖĄė”±Óė”°ČČ½ā”±µÄ¹ż³Ģ¾łŠčŅŖŌŚĪŽĖ®”¢ĪŽŃõµÄĢõ¼žĻĀ£¬ŌŅņŹĒ_________________”£
£Ø4£©ÉĻŹöÉś²ś¹¤ŅÕÖŠæÉŃ»·Ź¹ÓƵÄĪļÖŹŹĒ_________”¢________£ØĢī»ÆѧŹ½£©”£
¢ņ£®Ņ±½š¼¶øß“æ¹čÖŠ³£ŗ¬ÓŠĪ¢ĮæµÄŌÓÖŹŌŖĖŲ£¬±ČČēĢś”¢ÅšµČ£¬Šč¶ŌĘä½ųŠŠ²ā¶Ø²¢³żŌÓ£¬ŅŌ½ųŅ»²½Ģįøß¹čµÄ“æ¶Č”£
£Ø5£©²ā¶ØŅ±½š¼¶øß“æ¹čÖŠĢśŌŖĖŲŗ¬Įæ
½«m g ѳʷÓĆĒā·śĖįŗĶĻõĖįČܽā“¦Ąķ£¬Åä³ÉV mL ČÜŅŗ£¬ÓĆōĒ°·£ØNH2OH£¬ÄѵēĄė£©½«Fe3+»¹ŌĪŖFe2+ŗ󣬼ÓČė¶žµŖŌÓ·Ę£¬ŠĪ³ÉŗģÉ«ĪļÖŹ”£ĄūÓĆĪü¹ā¶Č·Ø²āµĆĪü¹ā¶ČA ĪŖ0.500£ØĪü¹ā¶ČAÓėFe2+ÅØ¶Č¶ŌÓ¦ĒśĻßČēĶ¼£©”£

¢Ł ĖįŠŌĢõ¼žĻĀ£¬ōĒ°·½«Fe3+»¹ŌĪŖFe2+£¬Ķ¬Ź±²śÉśŅ»ÖÖĪŽĪŪČ¾ĘųĢ壬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________________________”£
¢Ś ѳʷ֊ĢśŌŖĖŲµÄÖŹĮæ·ÖŹż±ķ“ļŹ½ĪŖ____________________£ØÓĆ×ÖÄø±ķŹ¾£©”£
£Ø6£©ĄūÓĆŃõ»Æ»Ó·¢·Ø³żŅ±½š¼¶øß“æ¹čÖŠµÄÅšŌŖĖŲ
²ÉÓĆArµČĄė×ÓŃę£¬·Ö±š¼ÓČėO2»ņCO2£¬ŃŠ¾æÅšŌŖĖŲµÄČ„³żĀŹŗĶ¹čŌŖĖŲµÄĖšŹ§ĀŹ£¬ŹµŃé½į¹ūČēĻĀĶ¼ĖłŹ¾”£ŌŚŹµ¼ŹÉś²ś¹ż³Ģ£¬Ó¦µ÷½ŚO2»ņCO2µÄŗĻĄķ±ČĄżµÄŌŅņŹĒ________________”£
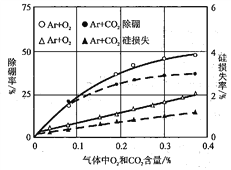
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éČČ»Æѧ·½³ĢŹ½ÖŠ£¬”÷H1>”÷H2µÄŹĒ( )
¢ŁC(s)+O2(g)=CO2(g) ”÷H1 C(s)+1/2O2(g)=CO (g) ”÷H2
¢ŚS(s)+O2(g)=SO2(g) ”÷H1 S(g)+O2(g)=SO2(g) ”÷H2
¢ŪH2(g)+ ![]() O2(g)=H2O(l) ”÷H1 2H2(g)+ O2(g)=2H2O(l) ”÷H2
O2(g)=H2O(l) ”÷H1 2H2(g)+ O2(g)=2H2O(l) ”÷H2
¢ÜCaCO3(s)=CaO(s)+CO2(g) ”÷H1 CaO(s)+H2O(l)=Ca(OH)2(s) ”÷H2
A. ¢Ś¢Ū¢Ü B. ¢Ł C. ¢Ü D. ¢Ł¢Ś¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×Ó£¬ÄÜŌŚČÜŅŗÖŠ“óĮæ¹²“ęµÄŹĒ
A. Na+ ӢMg2+ ӢCl- ӢSO42- B. Na+ ӢCa2+ ӢCO32- ӢNO3-
C. Na+ ӢH+ ӢCl- ӢCO32- D. K+ ӢAl3+ ӢSO42- ӢOH-
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com