
【题目】将2.56 g Cu和一定量的浓硝酸反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A.0.13 molB.1 molC.1.05 molD.0.05 mol
【答案】A
【解析】
Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据N元素守恒,消耗硝酸中N的原子转化成硝酸铜中的N原子和氮的氧化物中N原子,据此分析;
Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,消耗硝酸的物质的量为2n[Cu(NO3)2]+n(NO、NO2)=2×![]() +
+![]() =0.13mol,故A正确;
=0.13mol,故A正确;
答案:A。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品
闻名中外,曾主要用于造币,亦可用于制作仿银饰品![]() 回答下列问题:
回答下列问题:
![]() 镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为______.
镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为______.
![]() 硫酸镍溶于氨水形成
硫酸镍溶于氨水形成![]() 蓝色溶液.
蓝色溶液.
![]() 中阴离子的立体构型是______.
中阴离子的立体构型是______.
![]() 在
在![]() 中
中![]() 与
与![]() 之间形成的化学键称为___,提供孤电子对的成键原子是______.
之间形成的化学键称为___,提供孤电子对的成键原子是______.
![]() 氨是______分子
氨是______分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() ,中心原子的轨道杂化类型为______.
,中心原子的轨道杂化类型为______.
![]() 单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为:
单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为:![]() 、
、![]() 的原因是______.
的原因是______.
![]() 某镍白铜合金的立方晶胞结构如图所示.
某镍白铜合金的立方晶胞结构如图所示.
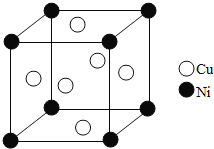
![]() 晶胞中铜原子与镍原子的数量比为______.
晶胞中铜原子与镍原子的数量比为______.
![]() 若合金的密度为
若合金的密度为![]() ,晶胞参数
,晶胞参数![]() ______nm.
______nm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性KMnO4溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
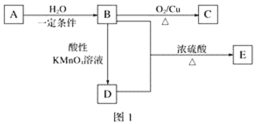

请回答下列问题:
(1)A的结构简式为___________,D中的官能团为_________。(写名称)
(2)A生成B的反应类型为__________________________
(3)由B生成C的反应方程式为______________________反应类型是__________。
(4)B与D反应生成E的化学方程式为______________________反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些元素的信息,其中有一种元素不在短周期。
元素A | 元素B | 元素C | 元素X | 元素Y |
单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
根据上述信息回答下列问题:
(1)写出X3的等电子体_____(写一个即可),基态Y原子核外电子所占据的最高能级的电子云形状为______。
(2)A元素在元素周期表中的___区,基态A原子的未成对电子有___个。
(3)B、C、X的简单离子半径由大到小的顺序为______(填离子符号)。
(4)HX与HY两种共价键中,键的极性较强的是____,键长较长的是____(X、Y用元素符号表示)。
(5)Y与碳元素形成的一种阴离子与Y2是等电子体,请写出该阴离子的电子式___。Y的常见氢化物易溶于水的主要原因是___。
(6)铂丝蘸取化合物CB在酒精灯上灼烧,火焰呈___色,显色原因是___(填序号)。
A.CB受热挥发 B.CB受热分解
C.C离子中电子跃迁 D.B离子中电子跃迁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于碳碳双键(![]() )中的π键不能自由旋转,因此
)中的π键不能自由旋转,因此 ![]() 和
和 是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯类异构体有
是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯类异构体有
A. 5种B. 6种C. 7种D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示原电池装置的说法错误的是( )
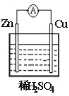
A.Zn为负极,反应为Zn-2e-=Zn2+B.铜棒上发生还原反应
C.电子从锌片经导线流向铜片D.溶液中氢离子浓度保持不变,溶液中SO42-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
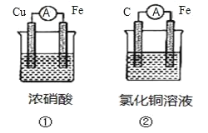
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com