
【题目】A、B、C、D、E、F为原子序数依次增大的五种短周期主族元素,A的简单离子核外没有电子,B、C、D位于同一周期,D、E位于同一主族,B元素在自然界中形成的化合物种类最多,D元素的氢化物是最常用的溶剂。
请回答:
(1)BD2的电子式___________________________;
(2)C、D、F离子半径由大到小的顺序为_________________(用离子符号表示)
(3)用一个化学方程式表示证明非金属性F>E:_____________________________
(4)X、Y两种化合物均是强电解质,且均由A、C、D三种元素组成的,X能抑制水的电离,Y能促进水的电离,在一定条件下,X、Y可以相互转化。写出X转化成Y的化学方程式_______________________。
(5)用下面的装置和药品探究A2ED3与AFD的酸性的强弱:

装置连接顺序为_______________(用字母表示),其中装置C的作用是__________________。
【答案】 ![]() Cl->N3->O2- H2S+Cl2=2HCl+S↓ HNO3+NH3=NH4NO3 ACBEDF 除去HCl气体
Cl->N3->O2- H2S+Cl2=2HCl+S↓ HNO3+NH3=NH4NO3 ACBEDF 除去HCl气体
【解析】A、B、C、D、E、F为原子序数依次增大的五种短周期主族元素,A的简单离子核外没有电子,A是H;B、C、D位于同一周期,D、E位于同一主族,B元素在自然界中形成的化合物种类最多,B是C,D元素的氢化物是最常用的溶剂,D是O,因此C是N,E是S,F是Cl。则
(1)CO2是共价化合物,电子式为![]() ;(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,因此C、D、F离子半径由大到小的顺序为Cl->N3->O2-;(3)氯气能置换出硫,说明非金属性Cl>S,反应的方程式为H2S+Cl2=2HCl+S↓;(4)X、Y两种化合物均是强电解质,且均由A、C、D三种元素组成的,X能抑制水的电离,Y能促进水的电离,因此X是硝酸,Y是硝酸铵,所以X转化成Y的化学方程式为HNO3+NH3=NH4NO3。(5)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断。A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,因此装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体。
;(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,因此C、D、F离子半径由大到小的顺序为Cl->N3->O2-;(3)氯气能置换出硫,说明非金属性Cl>S,反应的方程式为H2S+Cl2=2HCl+S↓;(4)X、Y两种化合物均是强电解质,且均由A、C、D三种元素组成的,X能抑制水的电离,Y能促进水的电离,因此X是硝酸,Y是硝酸铵,所以X转化成Y的化学方程式为HNO3+NH3=NH4NO3。(5)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断。A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,因此装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】NaN3+KNO3→N2↑+K2O+Na2O此方程式是汽车剧烈碰撞时,安全气囊中发生的反应。对上述反应的描述错误的是( )
A. NaN3是还原剂,KNO3是氧化剂
B. 该反应中有一种元素的化合价发生变化
C. 若生成8 mol N2,则转移电子的物质的量为5 mol
D. 配平后物质的系数依次为10、2、1、5、16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为原料进行特定反应的装置.
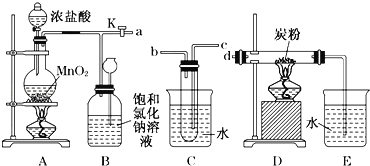
(1)写出A装置中发生反应的离子方程式 __________;要将C装置接入B和D之间,正确的接法是:a→ _____→ _____→d;
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl 2 充满整个装置,再点燃D处的酒精灯,Cl 2 通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO 2 和HCl(g),发生反应的化学方程式为 _________.
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl 2 产生,此时B中的现象是 ______________________,B的作用是________________________.
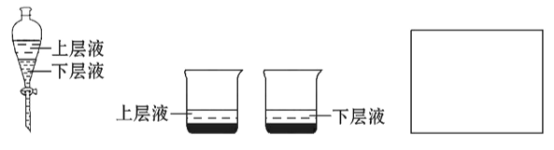
(4)用量筒量取20mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10mL CCl4 ,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是___________________ (填“上层液”或“下层液”),能使有色布条褪色的是_________(填“上层液”或“下层液”).
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
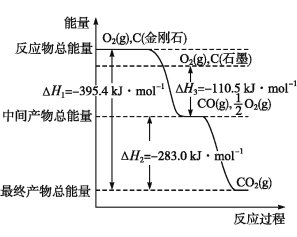
①在通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1。
N2(g)+O2(g)![]() 2NO(g) ΔH=180.0 kJ·mol1。
2NO(g) ΔH=180.0 kJ·mol1。
NO分子中化学键的键能为 kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将C12缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程溶液中H+的浓度变化如图所示。(已知常温常压下C12溶于水时,只有部分C12会和水发生反应)下列叙述正确的是

A. ①处溶液的酸性比②处溶液的酸性强
B. 依据②处c(H+)可计算溶解的C12的物质的量
C. 整个实验过程中,溶液的颜色先变深后变浅,最后变为无色
D. ④处表示C12与NaOH溶液恰好完全反应,共转移了0.1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究特点。
已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.2 kJ·mol1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2H2S(g)![]() 2H2(g)+S2(g) ΔH=+169.8 kJ·mol1
2H2(g)+S2(g) ΔH=+169.8 kJ·mol1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
______________________________。
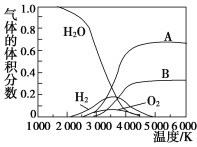
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:

在25℃时,下列选项不正确的是( )
A. 反应 CN-+ H2O + CO2 =HCN + HCO3-能够发生
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者
C. 物质的量浓度相等的 HCOONa 和 KCN 溶液中:c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+)相等的 HCOONH4 溶液、NH4CN 溶液、NH4HC03 溶液:c(NH4HC03) >c(NH4CN) >c(HCOONH4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com