
| A. | 用pH试纸测得该消毒液的pH约为12 | |
| B. | 该消毒液中,Fe3+、K+、NO${\;}_{3}^{-}$、CH3CHO可以大量共存 | |
| C. | 向该消毒液中滴入少量Na2SO3溶液,反应的离子方程为:SO${\;}_{3}^{2-}$+ClO-=Cl-+SO${\;}_{4}^{2-}$ | |
| D. | 向该消毒液中加入浓盐酸,每产生1mol Cl2,转移电子数约为2×6.02×1023 |
分析 A.NaClO具有漂白性,不能用pH试纸测定pH;
B.CH3CHO能被NaClO氧化;
C.NaClO与Na2SO3发生氧化还原反应生成NaCl和硫酸钠;
D.根据方程式ClO-+Cl-+2H+=Cl2↑+H2O计算.
解答 解:A.NaClO具有漂白性,能使pH褪色,所以不能用pH试纸测定pH,故A错误;
B.NaClO具有强氧化性,能与CH3CHO发生氧化还原反应,所以不能大量共存,故B错误;
C.NaClO与Na2SO3发生氧化还原反应生成NaCl和硫酸钠,其反应的离子方程式为:SO32-+ClO-=Cl-+SO42-,故C正确;
D.向该消毒液中加入浓盐酸,反应方程式为ClO-+Cl-+2H+=Cl2↑+H2O,反应中产生1mol Cl2转移电子1mol,即转移电子数约为6.02×1023,故D错误.
故选C.
点评 本题考查了氧化还原反应、离子共存、pH试纸的使用等,侧重于考查氧化还原反应以及物质氧化性的应用,题目难度中等,注意把握NaClO的性质.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:多选题
| A. | 淀粉(氯化钠)渗析 | |
| B. | 硬脂酸钠(甘油溶液)盐析、过滤 | |
| C. | 水(鸡蛋清)蒸馏 | |
| D. | 蔗糖(葡萄糖)与银氨溶液混合水浴加热,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 氢化物的稳定性:SiH4>H2S>H2O>HF | D. | 原子半径:F<O<S<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
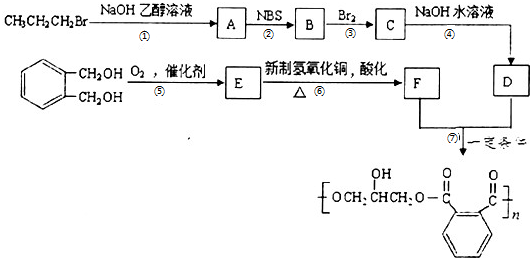
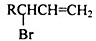
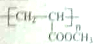 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢和铁 | B. | 金刚石和石墨 | C. | 红磷和白磷 | D. | 氧气和臭氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: 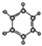 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,LiMn2O4发生氧化反应,电池内部Li+向正极移动 | |
| B. | 放电时,正极反应为:Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 醋酸可用作锂离子电池的电解质 | |
| D. | 充电时,锂的碳材料为阳极且反应为:Li++e-═Li |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com