
| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:填空题
(1)按要求写出下列反应的离子方程式
①人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用胃舒平【氢氧化铝】给病人治疗。该反应的离子方程式为
②实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式 常用澄清石灰水检验CO2气体的离子方程式是
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是 反应片刻后,可观察到有气体产生,其离子方程式是
(2)按要求将化学方程式改为离子方程式2Na2O2+2H2O=4NaOH+O2↑
( 3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式
3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式
(4)有一瓶无色澄清溶液,其中可能含有H+、Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子。现进行以下实验:
A、用PH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有 ;肯定不存在的离子有 ;可能存在的离子有 。
②写出C中发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A. 14C和14N互为同位素 B. 14C和C60是同分异构体
C. 146C核素中的中子数为8 D. 14CO2?的摩尔质量为46
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于α | B. | 大于α | C. | 小于α | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙提高相同温度 | B. | 甲中加入1molHe,乙不变 | ||
| C. | 甲降低温度,乙不变 | D. | 甲增加1molH2,乙增加1molI2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
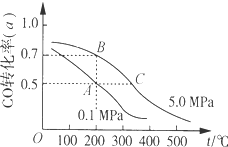
| A. | A、B两点表示在某时刻达到平衡状态,此时A、B两点时容器中,n(A)总:n(B)总=4:5 | |
| B. | 在A点时保持恒温恒容,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) | |
| C. | 若开始时向容器中充入1mol CO与2mol H2,达到平衡(与A点相同温度压强)时,CO的 转化率小于50% | |
| D. | 在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
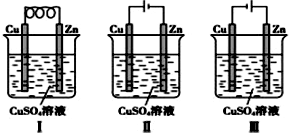
| A. | Ⅰ是原电池,Ⅱ是电镀装置 | |
| B. | Ⅰ、Ⅱ装置中锌极上均发生氧化反应 | |
| C. | Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 | |
| D. | Ⅱ、Ⅲ装置中Cu2+浓度基本不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com