

分析 将废旧镍电池电极材料溶于稀盐酸,发生反应Ni(OH)2+2HCl=NiCl2+2H2O、Fe2O3+6HCl=2FeCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑,过滤得到的残渣是C,向滤液中加入NiO,条件溶液的pH,根据流程图知,生成的沉淀应该是Fe(OH)3、Al(OH)3,然后向滤液中加入Na2C2O4溶液,发生反应NiCl2+Na2C2O4=NiC2O4↓+2NaCl,过滤,将滤液电解,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,过滤得到的NiC2O4和NaOH反应生成Ni(OH)2,用氯气将Ni(OH)2氧化生成Ni(OH)3,最后洗涤沉淀得到较纯净的Ni(OH)3,根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,充电时消耗氢氧根,阴极附近溶液的pH升高,据此分析解答.
解答 解:将废旧镍电池电极材料溶于稀盐酸,发生反应Ni(OH)2+2HCl=NiCl2+2H2O、Fe2O3+6HCl=2FeCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑,过滤得到的残渣是C,向滤液中加入NiO,条件溶液的pH,根据流程图知,生成的沉淀应该是Fe(OH)3、Al(OH)3,然后向滤液中加入Na2C2O4溶液,发生反应NiCl2+Na2C2O4=NiC2O4↓+2NaCl,过滤,将滤液电解,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,过滤得到的NiC2O4和NaOH反应生成Ni(OH)2,用氯气将Ni(OH)2氧化生成Ni(OH)3,根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,充电时消耗氢氧根,阴极附近溶液的pH升高.
(1)通过以上分析知,酸溶时能与盐酸反应的物质是Al、Ni(OH)2、Fe2O3,故答案为:碳粉;
(2)用NiO调节溶液的pH,析出沉淀的成分为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(3)加入Na2C2O4溶液后反应的化学方程式为NiCl2+Na2C2O4=NiC2O4↓+2NaCl,故答案为:NiCl2+Na2C2O4=NiC2O4↓+2NaCl;
(4)加入NaOH溶液,NiC2O4沉淀转化为Ni(OH)2,NiC2O4+2OH-?Ni(OH)2+C2O42-,根据Ksp(NiC2O4):4.0×10-10
c(Ni2+)=c(C2O42-)=$\sqrt{Ksp}$=$\sqrt{4.0×1{0}^{-10}}$=2×10-5mol/L;根据Ksp(Ni(OH)2):5.0×10-16,c2(OH-)=$\frac{Ksp[Ni(OH)_{2}]}{c(N{i}^{2+})}$=$\frac{5.0×1{0}^{-16}}{2.0×1{0}^{-5}}$=2.5×10-11mol2/L2;则该反应的平衡常数$\frac{C({C}_{2}{{O}_{4}}^{2-})}{{C}^{2}(O{H}^{-})}$=$\frac{2×1{0}^{-5}}{2.5×1{0}^{-11}}$=8×105L/mol;
故答案为:NiC2O4+2OH-?Ni(OH)2+C2O42-;8×105L/mol;
(5)电解过程中阴极反应是水得电子产生氢气,电解NaCl溶液可以得到氧化性物质氯气,所以沉淀Ⅲ可被电解所得产物Cl2氧化生成Ni(OH)3,故答案为:2H2O+2e-═H2↑+2OH-;2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-;
(6)A、根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,故A正确;
B、充电时消耗氢氧根,阴极附近溶液的pH升高,故B错误;
C、电池放电时,负极反应为Fe+20H--2e-=Fe(OH)2,故C正确;
D、电池充电时,阳极反应为2Ni(OH)2+20H--2e-=Ni2O3+3H2O,故D正确,
故答案为:B.
点评 本题考查混合物的分离和提纯,侧重考查分析、推断、计算能力,涉及离子反应方程式的书写、平衡常数的计算、沉淀的洗涤等知识点,综合性较强,为高考高频点,明确每一步中发生的反应及物质的性质、物质分离方法即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C2H6、C2H4O | B. | C2H4O、C2H4O2 | C. | C2H6O、C3H6O3 | D. | C3H8O3、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积减半,则N2O4的浓度为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 平衡向右移动,但混合气体密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “熬胆矾铁釜,久之变化为铜”,该过程发生了置换反应 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验现象 | 解释与结论 | |
| A | 向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解 | 该无色溶液一定是硝酸 |
| B | 将某气体通入品红溶液中,品红溶液颜色 | 该气体一定是SO2 |
| C | SO2气体通过Ba(NO3)2溶液中,溶液出现浑浊现象 | 说明有BaSO3沉淀生成 |
| D | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色 | 说明HCO3在水溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{235}$U的原子核外有143个电子 | B. | ${\;}_{\;}^{235}$U、${\;}_{\;}^{238}$U是同一种核素 | ||
| C. | ${\;}_{\;}^{235}$U一个原子中有92个中子 | D. | ${\;}_{\;}^{235}$U和${\;}_{\;}^{238}$U互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol丙烯酸中含有双键的数目为0.2NA | |
| B. | 丙烯和1-丁烯组成的21g混合气体中氢原子的个数为3NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
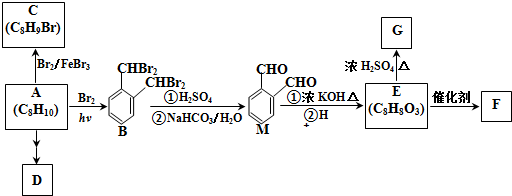

 .由A生成B的反应过程中,会同时生成多种副产物,其中一种与B互为同分异构体,它的核磁共振氢谱有5个吸收峰.
.由A生成B的反应过程中,会同时生成多种副产物,其中一种与B互为同分异构体,它的核磁共振氢谱有5个吸收峰. .
.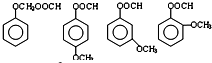 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com