
【题目】下列各组分子中,都属于含极性键的非极性分子的是
A. CO2、H2SB. C60、C2H4C. C2H4、CH4D. NH3、HCl
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是 ( )
A. VSEPR模型可用来预测分子的立体结构
B. 分子中价电子对相互排斥决定了分子的空间结构
C. 中心原子上的孤电子对不参与互相排斥
D. 分子中键角越大,价电子对相互排斥力越小,分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭的容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容器扩大到原来的两倍,在达平衡时,测得A的浓度降低为0.5 mol/L.下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容器扩大到原来的两倍,在达平衡时,测得A的浓度降低为0.5 mol/L.下列有关判断正确的是
A. x+y<z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:
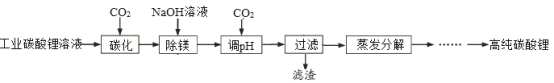
(1)实验室中在下图所示装置中进行碳化反应:

①碳化反应的主要反应离子方程式为 。
②碳化时温度需控制在30℃,可采取的措施是 。
温度不宜过高的原因是 。
(2)用CO2调pH为8—9,其目的是 。
(3)已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如图:
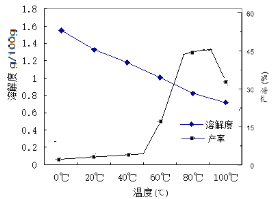
90℃以下,随温度升高,碳酸锂产率升高的原因可能是 。
(4)请补充完整由滤液制备高纯碳酸锂的实验方案:取滤液放置于烧杯中 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示。
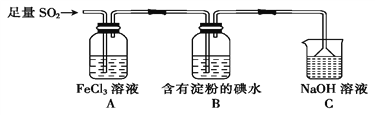
(1)装置C的作用是_____________________。
(2)①设计实验方案检验有Fe2+生成:_______________________。
②证明SO2气体还原I2的现象:_______________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤为蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填字母)。
A.蒸发皿 B.试管夹 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A. Na+、H+、Cu2+、NO3- B. Na+、Fe2+、H+、NO3-
C. NH4+、Cl-、SO42-、OH- D. HCO3-、NH4+、Na+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素最高价氧化物的水化物反应的离子方程式: 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
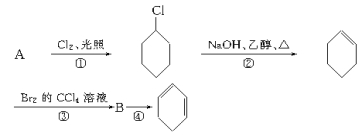
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
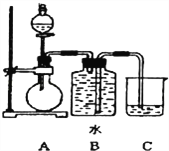
【题目】如图装置可以用来制取某些气体.
(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是__________(填电子式)分液漏斗中盛放的是______,目的是______________________________________.
(2)实验室中制备乙炔的反应原理是______________________________________.
(3)用此方法制取的乙炔气体通常混有H2S气体,如何除去?____(填化学试剂)
(4)还能用该装置制备和收集的气体有(答出任意一种即可)______________.
(5)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是_________,改进时还需要的玻璃仪器是_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com