


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
查看答案和解析>>
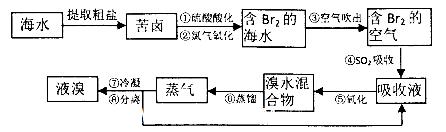
科目:高中化学 来源:不详 题型:实验题
| A.澄清石灰水,浓H2SO4 | B.酸性KMnO4,浓H2SO4 |
| C.溴水,浓H2SO4 | D.浓H2SO4,溴水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
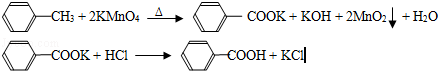
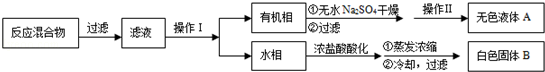
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, _________ _________ | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, _________ | 生成白色沉淀 | 滤液含Cl﹣ |
| ③ | 干燥白色晶体, _________ | _________ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
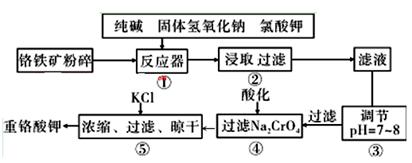
 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。| A.x ="0.5" ,a =8 | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
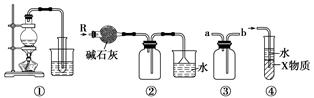
| A.装置①可制取少量蒸馏水 |
| B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集H2、CO2、Cl2、HCl、NO等气体 |
| D.装置④中X物质若为四氯化碳,则可用于吸收氨气或氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com