
 支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )| A. | 通入保护电流使钢管桩表面腐蚀电流接近于零 | |
| B. | 通电后外电路电子被强制从高硅铸铁流向钢管桩 | |
| C. | 高硅铸铁的作用是作为损耗阳极材料和传递电流 | |
| D. | 通入的保护电流应该根据环境条件变化进行调整 |
分析 外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极,电子从电源负极流出,给被保护的金属补充大量的电子,使被保护金属整体处于电子过剩的状态,让被保护金属结构电位低于周围环境,从而使得金属腐蚀发生的电子迁移得到抑制,避免或减弱腐蚀的发生,阳极若是惰性电极,则是电解质溶液中的离子在阳极失电子,据此解答.
解答 解:A.被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱腐蚀的发生,故A正确;
B.通电后,惰性高硅铸铁作阳极,海水中的氯离子等在阳极失电子发生氧化反应,电子经导线流向电源正极,再从电源负极流出经导线流向钢管桩,故B正确;
C.高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,故C错误;
D.在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,故D正确;
故选C.
点评 本题考查金属的电化学腐蚀与防护,明确外加电流阴极保护法的工作原理是解答本题的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:填空题
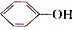 )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子 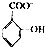 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是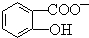 中形成分子内氢键,使其更难电离出H+,故Ka2<Ka.
中形成分子内氢键,使其更难电离出H+,故Ka2<Ka.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:Na+、K+、MnO4-、SO42- | |
| B. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| C. | 使酚酞变红色的溶液:Na+、Al3+、CO32-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 海水中含有丰富的碘元素,因此碘被称为“海洋元素” | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 待加工铝质工件为阳极 | |
| B. | 可选用不锈钢网作为阴极 | |
| C. | 阴极的电极反应式为:Al3++3e-═Al | |
| D. | 硫酸根离子在电解过程中向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳使Na2O2固体变白 | B. | 氯气使KBr溶液变黄 | ||
| C. | 乙烯使Br2的四氯化碳溶液褪色 | D. | 氨气使AlCl3溶液产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 | |
| B. | 绿色化学要求从源头上消除或减少生产活动对环境的污染 | |
| C. | 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 | |
| D. | 天然气和液化石油气是我国目前推广使用的清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
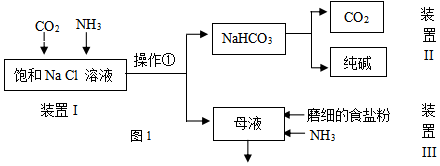
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com