
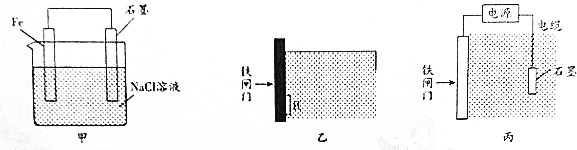
分析 (1)甲形成原电池反应,溶液呈中性,可发生吸氧腐蚀,正极发生还原反应;
(2)为防止铁腐蚀,形成牺牲阳极的阴极保护法,铁为正极;
(3)图丙为外加电源的阴极保护法,铁闸门为阴极;
(4)电镀时,镀层金属为阳极,待镀金属为阴极,电解质溶液含有镀层金属离子;镀层磨损后,镀铜铁形成原电池反应,铁为负极.
解答 解:(1)甲形成原电池反应,溶液呈中性,可发生吸氧腐蚀,正极发生还原反应,电极方程式为,故答案为:吸氧;O2+4e-+2H2O=4OH-;
(2)为防止铁腐蚀,形成牺牲阳极的阴极保护法,铁为正极,负极为较铁活泼的金属,但因钠与水反应,不能用钠,只有锌符合,故答案为:C;
(3)图丙为外加电源的阴极保护法,铁闸门为阴极,应连接电源的负极,故答案为:负;
(4)电镀时,镀层金属为阳极,待镀金属为阴极,电解质溶液含有镀层金属离子,铜为阳极,铁为阴极,电解质溶液可为硫酸铜;镀层磨损后,镀铜铁形成原电池反应,铁为负极,易被腐蚀,铁比铜活泼,形成原电池反应时,铁为负极,铜为正极,镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,而锌比铁活泼,形成原电池反应时,铁为正极,锌为负极,铁难以被氧化,
故答案为:铜;铁;硫酸铜;镀层破损后,镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁为正极被保护.
点评 本题考查原电池知识,侧重于金属的腐蚀与防护的考查,为高频考点,注意把握原电池的工作原理以及金属的防护方法,难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他步骤正确,滴定达到终点时,俯视读数,测得c(H+)偏大 | |
| B. | 实验测得25℃时,HgI2的Ksp=4×10-9 | |
| C. | 一定温度下,向HgI2饱和溶液中加入少量Hg(NO3)2溶液,HgI2的Ksp减小 | |
| D. | 温度不变,在t时,向HgI2饱和溶液中加入少量浓KI溶液,离子浓度变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com