
| A. | Na2CO3、NaHCO3两种盐的溶液中,离子种类不相同 | |
| B. | 常温下1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中c (CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 | |
| D. | 常温下,某溶液中由水电离出的c(H+)为10-5mol/L,则此溶液可能是盐酸 |
分析 A.NaHCO3溶液和Na2CO3溶液都含有钠离子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子;
B.1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,生成醋酸钠,醋酸根水解使溶液呈碱性;
C.根据NH4HSO4电离出的H+对NH4+的水解起到抑制作用,从盐类水解的影响因素以及平衡移动的角度分析;
D.常温下某溶液中由水电离产生的c(H+)=1×10-5mol/L,说明水的电离被促进,依据影响水电离平衡的因素.
解答 解:A.NaHCO3溶液和Na2CO3溶液都含有钠离子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子,故A错误;
B.常温下1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,生成醋酸钠,醋酸根水解使溶液呈碱性,c(Na+)>c (CH3COO-)>c(OH-)>c(H+),故B错误;
C.等物质的量浓度的NH4HSO4与NH4Cl溶液,NH4HSO4电离出的H+对NH4+的水解起到抑制作用,所以c(NH4+):前者<后者,故C正确;
D.常温下某溶液中由水电离产生的c(H+)=1×10-5mol/L,促进水的电离,可能是水解显酸性的盐,盐酸抑制水的电离,不可能是盐酸,故D错误;
故选C.
点评 本题考查了盐类水解的应用、溶液酸碱性及水的电离,明确基本概念和原理是解题关键,题目难度不大,注意对基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
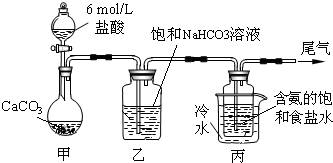
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
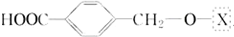 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备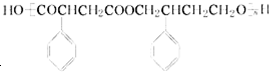 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | X、Y、Z离子半径依次增大 | |
| C. | Y和Z形成的简单离子都会破坏水的电离 | |
| D. | W、X、Z对应气态氢化物稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 记载中的反应属于置换反应 | B. | CuSO4溶液呈中性 | ||
| C. | 记载中L含了湿法炼铜的原理 | D. | 每生成1mol铜转移2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com