
 CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
. 分析 根据烷烃的通式CnH2n+2来计算;根据烷烃的通式CnH2n+2来计算;根据烷烃的通式CnH2n+2来计算;乙醇和乙酸在浓硫酸做催化剂的条件下能发生酯化反应;苯和氢气加成能生成环己烷.
解答 解:烷烃的通式为CnH2n+2,化学式为C11Hm的烷烃,将n=11带入2n+2得,m=24;CnH112的烷烃,则有2n+2=112,解得n=55;相对分子质量为226的烷烃,则12n+2n+2=226,所以n=16,即烷烃的分子式为C16H34;乙醇与乙酸在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;苯与氢气在催化剂条件下发生加成反应生成环己烷,方程式:
CH3COOCH2CH3+H2O;苯与氢气在催化剂条件下发生加成反应生成环己烷,方程式: .
.
故答案为:24;55;C16H34;CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O; .
.
点评 本题考查了烷烃通式在确定烷烃分子式时的应用和有机反应的书写,题目比较简单.注意基础的掌握.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | FeCl3溶液腐蚀印刷电路:Fe3++Cu=Fe2++Cu2+? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取一氯乙烷最好采用的方法是乙烷和氯化氢反应 | |
| B. | 化学平衡的标志之一是各物质的浓度相等 | |
| C. | C4H10的同分异构体有3种 | |
| D. | 乙烯能够使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +135 KJ•mol-1 | B. | -375 KJ•mol-1 | C. | -325 KJ•mol-1 | D. | +325 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COO Na,水的电离平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
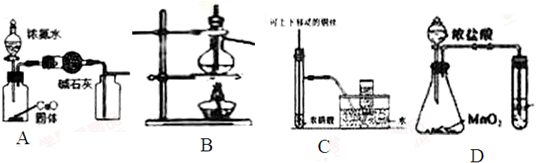
| A. | 制取并收集干燥纯净的NH3 | B. | 分离Br2和CCl4的混合物 | ||
| C. | 用于制备并收集少量NO | D. | 比较MnO2、Cl2、S 的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com