
 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:分析 (1)利用盖斯定律,结合已知的热化学方程式,
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1 ①
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2 kJ•mol-1 ②
①-②计算;
(2)温度升高,CO的转化率降低,说明升高温度平衡向逆反应方向移动;增大压强,平衡向正反应方向移动,则CO的转化率增大;结合图象,利用三段式法解答该题;
(3)煤炭气的主要成分为CO2和H2,在燃料电池中,负极通入燃料,正极通入氧气,熔融碳酸盐作电解质,所以正极反应式为O2+2CO2+4e-=2CO32-,负极反应式为CO+CO32--2e-=2CO2和H2+CO32--2e-=H2O+CO2.
解答 解:(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1,
利用盖斯定律将①-②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1,
故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1;
(2)①由图象可知,随温度的升高其转化率降低,说明升温时平衡逆向移动,正反应放热,
故答案为:放热;
②从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,
故答案为:A;
③增大反应物的转化率,即要使平衡向正向移动,而影响平衡移动的因素只有三个,温度、压强、浓度,本题只能是降温或加压,
故答案为:降温或加压;
④设加入COamol,则有H22amol
CO(g)+2H2(g)?CH3OH(g).
反应前(mol) a 2a 0
反应了(mol) 0.5a a 0.5a
平衡时(mol) 0.5a a 0.5a
可求得:$\frac{0.5a}{0.5a+a+0.5a}$×100%=25%
故答案为:25%;
(3)煤炭气的主要成分为CO2和H2,在燃料电池中,负极通入燃料,正极通入氧气,熔融碳酸盐作电解质,所以正极反应式为O2+2CO2+4e-=2CO32-,负极反应式为CO+CO32--2e-=2CO2和H2+CO32--2e-=H2O+CO2.故答案为:H2+CO32--2e-=H2O+CO2.
点评 本题考查了热化学方程式和盖斯定律的计算应用,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等,考查了学生的识图能力以及基础知识灵活运用的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol的NH3和1mol的NH4+都有10×6.02×1023个质子 | |
| B. | 室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)<Kb(NH3•H2O) | |
| C. | NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l);△H=-346kJ/mol | |
| D. | 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1gH2和8gO2 | |
| B. | 0.1molHCl和2.24LHe | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
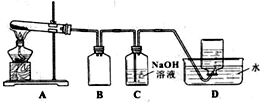 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②,振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
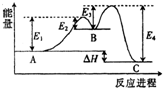
| A. | 两步反应均为吸热反应 | B. | 三种化合物中C最稳定 | ||
| C. | 加入催化剂会改变反应的反应热 | D. | A?B反应,反应条件一定要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na20和Na2O2的混合物共1mol,阴离子数目为NA | |
| B. | 1mol Na被完全氧化生成Na2O2,失去2NA个电子 | |
| C. | 7.8g Na2O2与足量CO2反应,转移的电子数为0.2NA | |
| D. | 1L 0.1mol•L-1的Na2S溶液中含有0.1NA S2-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com