
| A. | H-H=2H | B. | H2O(g)=H2O(l) | C. | H2+Cl2=2HCl | D. | NaOH (s)溶于水 |
分析 变化过程中的焓变大于0,说明该变化为吸热的过程,如化学键断裂,而物质有气体变为液态、燃烧反应及氢氧化钠溶于水都为放热,据此进行解答.
解答 解:A.H-H=2H过程为化学键的断裂,该过程为吸热反应,其焓变大于0,故A正确;
B.水蒸气具有的能量较高,H2O(g)=H2O(l)的过程放热,则其焓变小于0,故B错误;
C.H2+Cl2=2HCl为燃烧反应,属于放热反应,其焓变小于0,故C错误;
D.NaOH (s)溶于水为放热过程,其焓变小于0,故D错误;
故选A.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确反应热与焓变的关系为解答关键,注意掌握常见吸热反应、放热反应的类型,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
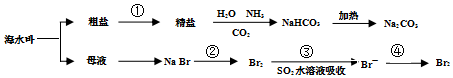
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第②、④步骤中,溴元素均被氧化 | |
| D. | 制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密 | |
| B. | 锂、钠、钾都保存在煤油中,密封 | |
| C. | 氨水、浓盐酸易挥发必须保存在棕色磨口细口瓶中 | |
| D. | 红磷无需密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在c(H+)=10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | n(N) | ||
| ① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
| ② | 800 | 0.20 | 0.80 | a | a |
| ③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
| A. | 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=12.5 | |
| C. | 实验②中,达到平衡时,a大于0.16 | |
| D. | 正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com