
Ksp(AgCl)��1.56��10��10 ��Ksp(AgBr)��7.7��10��13,Ksp(Ag2CrO4)��9.0��10��12 ,��֪��ij��Һ�к���C1-, Br- ��CrO42-��Ũ�Ⱦ�Ϊ0.010mo1��L-�������Һ����μ���0.010mol��L-1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ
A��C1- ��Br-��CrO42- B��CrO42-��Br-��C1-
C��Br-��C1-��CrO42- D��Br- ��CrO42-��C1-
C
��������
�����������������ʱ��AgCl��Һ��c��Ag+��= Ksp(AgCl)/ c��Cl-��=(1.56��10-10)/0.01=1.56��10-8mol/L��
AgBr��Һ��c��Ag+��= Ksp(AgBr)/ c��Cl-��=(7.7��10-13)/0.01mol/L=7.7��10-11mol/L��Ag2CrO4��Һ��c��Ag+��=[ Ksp(Ag2CrO4)/ c��CrO42-��]1/2=[(9.0��10-12)/0.01mol/L]1/2=3��10-5��c��Ag+��ԽС����Խ�����ɳ����������������Ӳ����������Ⱥ�˳��ΪBr-��Cl-��CrO42-��ѡC��
���㣺��������ܽ�ƽ�⡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���жԻ�ѧƽ���ƶ��ķ����У�����ȷ����
���Ѵ�ƽ��ķ�ӦC��s��+H2O��g�� CO��g��+H2��g���������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ�
CO��g��+H2��g���������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ�
���Ѵ�ƽ��ķ�ӦN2��g��+3H2��g�� 2NH3��g����������N2��Ũ��ʱ��ƽ��
2NH3��g����������N2��Ũ��ʱ��ƽ��
������Ӧ�����ƶ���N2��ת����һ������
��������μӵķ�Ӧƽ��ʱ������С��Ӧ���ݻ�ʱ��ƽ��һ���������������ķ����ƶ�
��������μӵķ�Ӧ��ƽ��ʱ���ں�ѹ��Ӧ���г���ϡ�����壬ƽ��һ�����ƶ�
A���٢� B���٢ڢ� C���ڢۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij���ʵľ����У���A��B��C����Ԫ�أ������з�ʽ��ͼ��ʾ������ǰ���������ϵ�Bԭ�Ӳ��ܻ�������

������A��B��C��ԭ�Ӹ���������Ϊ
A��1��3��1 B��2��3��1
C��2��2��1 D��1��3��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ����и߶���ѧ�ڵ�����������⻯ѧ�Ծ��������棩 ���ͣ������
��18�֣�����������ԭ��Ӧ��2Ag��(aq)��Cu(s)===Cu2��(aq)��2Ag(s)��Ƶ�ԭ��أ���ͼ��ʾ��

��ش��������⣺
��1���缫X�IJ�����________���������ҺY��________��Һ��(������)
��2�����缫Ϊ��ص�________���������ĵ缫��ӦΪ____________________________��X�缫�Ϸ����ĵ缫��ӦΪ____________________________��
��3�����·�еĵ����Ǵ�________������______��(��缫����)�����·��ÿͨ��0.1 mol���ӣ����缫���������������� g��
��4��ԭ��ع���ʱ�����ţ�װ����֬��KCl��U�ܣ����Cl������ �缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ����и߶���ѧ�ڵ�����������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£����淴Ӧ��X(g) + 3Y(g) 2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ�㣩,��Ӧ�ﵽƽ��ʱ, X��Y��Z��Ũ�ȷֱ�Ϊ0.1mol/L��0.3 mol/L��0.08 mol/L�������жϲ���ȷ����
2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ�㣩,��Ӧ�ﵽƽ��ʱ, X��Y��Z��Ũ�ȷֱ�Ϊ0.1mol/L��0.3 mol/L��0.08 mol/L�������жϲ���ȷ����
A��c1��c2 ��1��3
B��ƽ��ʱ��Y��Z��������֮��Ϊ3��2
C��X��Y��ת���ʲ����
D��c1��ȡֵ��ΧΪ0< c1< 0.14 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ����и߶���ѧ�ڵ�����������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������п��a��b�ֱ���������ϡ���ᡣͬʱ��a�м�������CuSO4��Һ��ͼ�в���H2�����V L��ʱ��t min�Ĺ�ϵ��ȷ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����12���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�̼�������仯�����ڹ�ũҵ����������������Ҫ���á���ش��������⣺
��1����CH4 ����ԭNOx �������������������Ⱦ�����磺
CH4(g) + 4NO2(g) =4NO(g)��CO2(g) + 2H2O(g) ��H1����574 kJ��mol��1
CH4(g) + 4NO(g) = 2N2(g)��CO2(g) + 2H2O(g) ��H2
��2 mol CH4 ��ԭNO2 ��N2�����������зų�������Ϊ1734 kJ����H2�� ��
��2���ݱ�������ѧ����һ������������Fe2O3����鷴Ӧ����ȡ���������Ľ��������䷴ӦΪ��Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) �SH>0
2Fe(s) + 3CO(g) +6H2(g) �SH>0
������Ӧ��5L���ܱ������н��У�1min��ﵽƽ�⣬���Fe2O3�ڷ�Ӧ����������3.2g����ö�ʱ����CO��ƽ����Ӧ����Ϊ________________��
�����÷�Ӧ�ں��º�ѹ�����н��У��ܱ����÷�Ӧ�ﵽƽ��״̬����__________
A��CH4��ת���ʵ���CO�IJ���
B����������ƽ����Է�����������
C��v��CO����v��H2���ı�ֵ����
D�����������������
�۸÷�Ӧ�ﵽƽ��ʱij���������¶ȱ仯��ͼ��ʾ�����¶���T1���ߵ�T2ʱ��ƽ�ⳣ��KA KB���>������<����=��������������Ա�ʾ������������Щ ��

A��H2���淴Ӧ����
B��CH4�ĵ��������
C����������ƽ����Է�������
D��CO���������
��3����ҵ�ϳɰ�����Ҫ�ķ�Ӧ�����dz����Ҳ����ͣ���һЩ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�ְ��ĵ绯ѧ�ϳɣ��Ӷ��������˵�����������ת���ʡ��绯ѧ�ϳɰ����̵��ܷ�ӦʽΪ��N2��3H2 2NH3���ù����л�ԭ��Ӧ�ķ���ʽΪ ��
2NH3���ù����л�ԭ��Ӧ�ķ���ʽΪ ��
��4������20mL 0.0lmol��L-l������HNO2��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯��ͼ��ʾ�������й�˵����ȷ����

�ٸ��ռ���Һ��Ũ��Ϊ0.02mol��L-1
�ڸ��ռ���Һ��Ũ��Ϊ0.01mol��L-1
��HNO2�ĵ���ƽ�ⳣ����b��>a��
�ܴ�b�㵽c�㣬�����Һ��һֱ���ڣ�c(Na+)>c(NO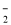 )>c(OH
)>c(OH )> c(H+)
)> c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ��̨�и�����ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ס��ҡ���������������֮�������ͼ��ʾת����ϵ���Ҽס��ҡ�����������ͬ��ij��Ԫ�ء������ƶϴ������
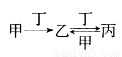
A������ΪCO2��������ǽ�̿
B������ΪO2���������N2
C������ΪFe���������Cl2
D������ΪCO2���������NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�¶ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1����д����ҵ�ϳɰ��Ļ�ѧ����ʽ ��
�����ϱ����ݿ�֪�÷�ӦΪ���ȷ�Ӧ�������� ��
�������ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��2��ԭ����H2��ͨ����Ӧ CH4(g) + H2O (g) CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е� 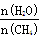 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
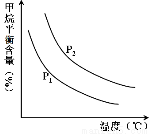
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1 P2���>������=����<������
�ڸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3��ԭ����H2����ͨ����ӦCO(g) + H2O(g)  CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ��
��T ��ʱ�����ݻ��̶�Ϊ5 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08 mol��L-1����ƽ��ʱCO��ת����Ϊ ���÷�Ӧƽ�ⳣ���ı���ʽΪ ��
�ڱ����¶���ΪT �棬�ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬���� ������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 1 : 1 : 1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com