氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐 和纯碱的原料,也是一种常用的制冷剂.
(1)实验室制备氨气的化学反应方程式为
.
(2)工业合成氨的反应方程式为:N
2(g)+3H
2(g)?2NH
3(g)△H.
图I是合成氨反应的 能量与反应过程相关图(未使用催化剂);图Ⅱ是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
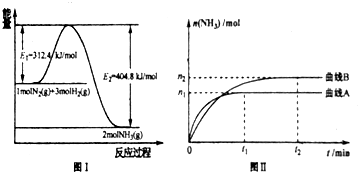
下列说法正确的是
.
A.△H=-92.4kJ/mol
B.使用催化剂会使E
1的数值增大
C.为了提高转化率,工业生产中反应的度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图.且P
A<P
BE.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且T
A>T
B;
F.该反应的平銜常数K
A<K
BG.在曲线A条件下,反应从开始到平衡,消耗N
2的平均速率为
mol?L
-1?min
-1(3)-定温度下,向一个容积为2L的密闭容器中通入2mol N
2和7mol H
2,达到平衡时 测得容器内的压强为起始时的
倍,则此温度下的平衡常数为
.在同一温度,同一容器中,将起始物质改为a mol N
2、b mol H
2、c mol NH
3(a,b,c均不为零)欲使4平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为(用含a,b,c的表达式表示)
.且欲使反应在起始时向逆反应方向进行,c的取值范围是
.
(4)已知H
2(g)的燃烧热为2S5.8kJ/mol.试写出表示NH
3(g)燃烧热的热化学反应方程式
以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为-
经测定,该电作过程中每 放出1mol N
2实际提供460kJ的电能,则该燃料电池的实际效率为
(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数).



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.