
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
科目:高中化学 来源: 题型:解答题
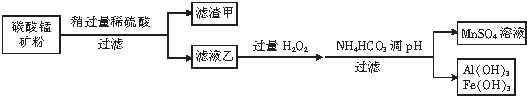
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
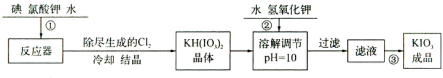
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol•L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1mol•L-1的H2SO4,充分振荡 | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在溶液中存在平衡:ClO-+H2O?HClO+OH-,加少量NaOH能提高其漂白效率 | |
| B. | 硫酸钡难溶子水,但硫酸钡属于强电解质 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 物质的量浓度相同的四种溶液:①氯化铵②硫酸氢铵 ③次氯酸铵④碳酸铵的pH:④>②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
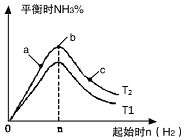 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 0.5 mol | C. | 0.75 mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=+269.8kJ/mol(反应热) | |
| D. | 2HCl(g)═Cl2(g)+H2(g);△H=-184.6kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75%酒精 | B. | 氢氧化铁胶体 | C. | 硝酸钠 | D. | 粗盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用手掰开一块金属钠,观察钠的颜色 | |
| B. | 钠投入硫酸铜溶液中,既有气体又有沉淀生成 | |
| C. | 氧化钠和过氧化钠可用作潜艇里氧气的来源 | |
| D. | 氧化钠和过氧化钠与二氧化碳反应的产物完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com