
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH4+ | |
| C. | 由水电离出的c(OH-)=1×10-12mol•L-1溶液中:NH4+、HCO3-、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14的溶液中:K+、Na+、I-、SiO32- |
分析 A.次氯酸钠具有强氧化性,能够氧化亚铁离子和碘离子;
B.该溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应;
C.该溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,铵根离子、碳酸氢根离子与氢氧根离子反应,碳酸氢根离子与氢氧根离子反应;
D.该溶液中存在大量氢氧根离子,四种离子不反应,都不与氢氧根离子反应.
解答 解:A.NaClO能够氧化Fe2+、I-,在溶液中不能大量共存,故A错误;
B.加入铝片能放出H2的溶液呈酸性或碱性,NH4+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.由水电离出的c(OH-)=1×10-12mol•L-1溶液中存在大量氢离子或氢氧根离子,NH4+、HCO3-与氢氧根离子反应,HCO3-与氢离子反应,在溶液中不能大量共存,故C错误;
D.该溶液呈碱性,溶液中存在大量氢氧根离子,K+、Na+、I-、SiO32-之间不反应,都不与氢氧根离子反应,在溶液中一定能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制取乙酸乙酯,提高其效率 | 加热,将乙酸乙酯蒸出 |
| B | 比较Mg、Al的金属性 | 分别将打磨过的镁带、铝片放入沸水中 |
| C | 羟基影响与其相连的苯环活性 | 分别将饱和溴水滴入苯和苯酚溶液中 |
| D | 制备Fe2O3固体 | 将H2O(g)通入装有铁粉的试管,加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
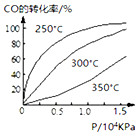 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
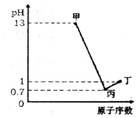 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | X、Y分别与W形成的化合物皆为离子化合物 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | Y、Z的简单离子都会影响水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 1L 0.1 mol•L-1Na2CO3溶液中CO32-和HCO3-离子数之和为0.1 NA | |
| C. | 密闭容器中0.5mol H2与0.5mol I2充分反应,得到HI的分子数为NA | |
| D. | 30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验用品(省略夹持装置) | 相应实验 |
| A | 蒸发皿、玻璃棒、泥三角、三脚架 | 从食盐水中获得NaCl晶体 |
| B | 烧杯、玻璃棒、漏斗、滤纸 | 除去氢氧化铝胶体中的泥沙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用胆矾配制100mL0.1mol/L的硫酸铜溶液 |
| D | 蒸馏烧瓶、温度计、冷凝管、石棉网、牛角管、锥形瓶、酒精灯 | 用四氯化碳萃取溴水中的溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、I-、SO42- | |
| B. | 使酚酞变红色的溶液:Na+、Al3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液:K+、Na+、NO3-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13 mol•L-1的溶液:Mg2+、Ca2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的物质性质均与2-丁烯相同 | |
| B. | 氧化性:O3>O2 | |
| C. | 常温常压下,22.4L的2-丁烯中含C-H键数目为8×6.02×1023个 | |
| D. | 1molO3参与该反应,转移的电子数为6×6.02×1023个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com