
【题目】按照要求回答下列问题:
(1)基态 Cr 原子的价电子排布式为_______,占据最高能层的电子的电子云轮廓图形状为__。
(2)在BF3分子中,硼原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________,写出BF
的立体构型为________,写出BF![]() 的一种等电子体_______。
的一种等电子体_______。
(3)Fe3+比 Fe2+更稳定的原因是_______________________________。
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:
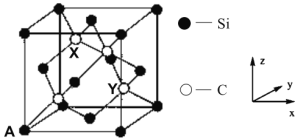
①金刚砂的化学式为_________。
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为____________。
【答案】3d54s1 球形 sp2 正四面体 CF4(或SiF4 、CCl4等) Fe3+的价电子构型为3d5, Fe2+的价电子构型为3d6, 前者为半满状态,所以Fe3+更稳定。 SiC (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)基态 Cr 原子为24号元素,价电子排布式为3d54s1;占据最高能层的电子的能级为4s,s轨道为球形,所以最高能层的电子的电子云轮廓图形状为球形;
(2)在BF3分子中,硼原子的孤电子对数为![]() ,杂化轨道数为3+0=3,所以杂化轨道类型为sp2; BF
,杂化轨道数为3+0=3,所以杂化轨道类型为sp2; BF![]() 中,硼原子的孤电子对数为
中,硼原子的孤电子对数为![]() ,价层电子对数为4+0=4,立体构型为正四面体; BF
,价层电子对数为4+0=4,立体构型为正四面体; BF![]() 的等电子体利用原子替换可以为CF4(或SiF4 、CCl4等);
的等电子体利用原子替换可以为CF4(或SiF4 、CCl4等);
(3) Fe3+的价电子构型为3d5,为半满状态较稳定,Fe2+的价电子构型为3d6,易失去一个电子为半充满稳定结构,所以Fe3+比Fe2+更稳定的原因是Fe3+的价电子构型为3d5, Fe2+的价电子构型为3d6, 前者为半满状态,所以Fe3+更稳定;
(4) ①晶胞中C原子在体心,Si原子在顶点和面心,根据均摊法得,C原子数目为4、Si原子数目为![]() ,所以金刚砂的化学式为SiC;
,所以金刚砂的化学式为SiC;
②把整个立方体分成8个相等的小立方体,X点在上层左后方的小立方体的体心,所以X 的原子坐标为(![]() ,
,![]() ,
,![]() )。
)。


科目:高中化学 来源: 题型:
【题目】某固体化合物X由5种元素组成。某学习小组进行了如下实验:

己知气体A能使湿润的红色石蕊试纸变蓝,气体F能使带火星的木条复燃。请回答:
(1)A的其空间构型为_______,往某蓝色盐溶液中缓慢通入气体A至过量的现象为________。
(2)写出X隔绝空气强热生成A、C、D的化学方程式________________________________。
(3)写出混合气体D与足量碘水反应的离子方程_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池。
(1)选用____为负极,___为正极,电解质溶液为_____。
(2)写出电极反应式:负极_____,正极_____。
(3)画出装置图: ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛用作化妆品的香精和定香剂,也是食品香料和调味剂,还可做抗癫痫药。香草醛的分子结构如图所示。下列关于香草醛的说法中不正确的是( )
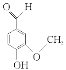
A.该化合物的分子式为C8H8O3
B.遇FeCl3溶液会显紫色
C.最多能与4 mol H2发生加成反应
D.该化合物可以发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g),△H=-QkJ/mol有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g),△H=-QkJ/mol有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2kJ;已知Q1=3Q2。下列叙述不正确的是
A. 甲中A的转化率为75%
B. Q1+Q2=Q
C. 达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正反应方向移动
D. 乙中的热化学方程式为2C(g)![]() A(g)+3B(g) ΔH=+Q2kJ/mol
A(g)+3B(g) ΔH=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:
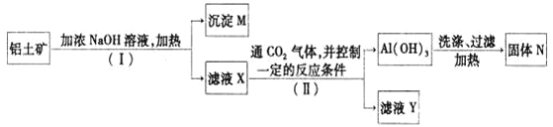
(1)![]() 和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
(2)沉淀M中除含有泥沙外,一定还含有_______,固体N是_______;
(3)滤液X中,含铝元素的溶质的化学式为______,它属于_____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加入___________
溶液中加入___________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ;
;
(5)将铝粉和氧化铁的混合物点燃,反应放出大量的热量,生成的液态的铁用来焊接铁轨。请写出反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.金刚石、石墨、C60 互为同素异形体
B.异丁烷和2-甲基丙烷互为同分异构体
C.CH4与C3H8一定互为同系物
D.35Cl 与37C1 是氯元素的两种核素,互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的的是( )
A.制取氨气 B.制取NaHCO3
B.制取NaHCO3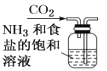
C.分离NaHCO3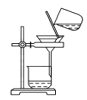 D.干燥NaHCO3
D.干燥NaHCO3 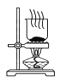
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。

Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com