
| A. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1880 kJ•mol-1 | |
| B. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2880 kJ•mol-1 | |
| C. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2560 kJ•mol-1 | |
| D. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1720 kJ•mol-1 |
分析 已知:①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
根据盖斯定律,②×6+③+①×6可得:6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g),反应热也进行相应的计算.
解答 解:已知:①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
根据盖斯定律,②×6+③+①×6可得:6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g),
则△H=6×396kJ•mol-1-1200kJ•mol-1+6×284kJ•mol-1=+2880kJ•mol-1,
故热化学方程式为:6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2880 kJ•mol-1,
故选:B.
点评 本题考查盖斯定律应用,关键是利用方程式结合构造目标热化学方程式,注意对盖斯定律的理解掌握.


科目:高中化学 来源: 题型:多选题
| A. | 用铂作催化剂 | B. | 降低温度 | ||
| C. | 缩小体积增大压强 | D. | 增大接触面积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+和Fe2+ | B. | Al3+和Na+ | C. | Fe2+和NH4+ | D. | Fe3+和Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
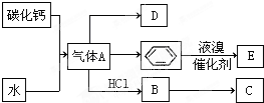
 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.
+HBr,其反应类型为取代反应. ,其反应类型为加聚反应.
,其反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:5 | C. | 1:9 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
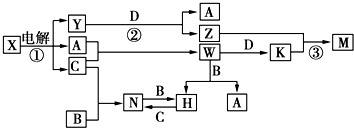
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:1 | B. | 10:1 | C. | 9:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 原因或结论 | |
| A | 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落. | 铝的熔点高于三氧化二铝 |
| B | 某溶液中加入硝酸银,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
| D | 向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com