
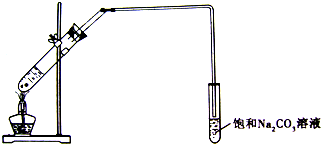
 俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯.回答下列问题:
俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯.回答下列问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
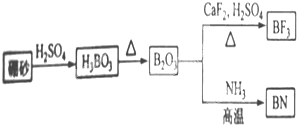
科目:高中化学 来源: 题型:
查看答案和解析>>
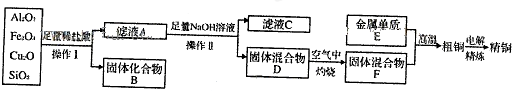
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B、该溶液中一定含有A13+、CO32-、Cl- |
| C、该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| D、Cl-可能含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64gSO2中含有的氧原子数为2NA |
| B、同温同压下,相同体积的任何气体所含原子个数相同 |
| C、40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2LH2O含有的电子数为5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com