
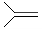
 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下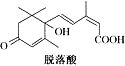 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )| A. | 其分子式为C15H22O4 | |
| B. | 其属于芳香族化合物 | |
| C. | 能与氢氧化钠溶液反应,但不能与碳酸氢钠溶液反应 | |
| D. | 该物质在一定条件下可发生自身取代反应生成含七元环的物质. |
分析 A.根据结构简式确定分子式;
B.含有苯环的有机物为芳香族化合物;
C.酚羟基、羧基、酯基能和NaOH溶液反应,只有羧基能和碳酸氢钠反应;
D.该物质中羧基和醇羟基能发生分子内酯化反应.
解答 解:A.根据结构简式确定分子式为C15H20O4,故A错误;
B.含有苯环的有机物为芳香族化合物,该物质中不含苯环,所以不能芳香族化合物,故B错误;
C.该物质中含有羧基,所以能与NaOH和碳酸氢钠反应,故C错误;
D.分子中含有羟基、羧基,可发生酯化反应,由羟基和羧基的相对位置可知在一定条件下发生反应生成含七元环的物质,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质和有机物的结构特点,易错选项是D,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定含Cu2+ | D. | 剩余固体中一定含Cu和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
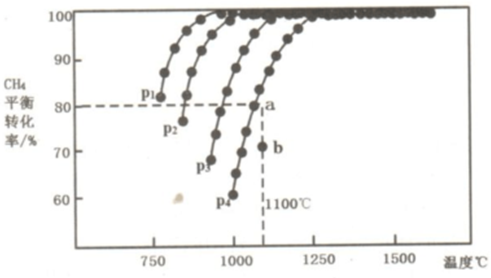
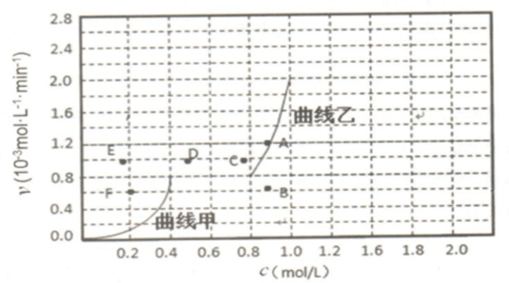
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 升高温度 | C. | 增加SO2浓度 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定没有乙炔 | B. | 混合气体中一定有乙稀 | ||
| C. | 混合气体可能由乙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com