
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
分析 将0.4mol/LNaHS溶液与0.2mol/LKOH溶液等体积混合,反应后溶质为0.05mol/L的Na2S,0.05mol/L的K2S和0.1mol/L的NaHS,由于HS-的水解程度大于电离程度,则溶液中HS-、S2-发生水解,溶液呈碱性,则c(OH-)>c(H+),由于HS-的水解程度小于S2-,则c(HS-)>c(K+)>c(S2-),溶液中离子浓度大小为:c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+),结合混合液中的电荷守恒、物料守恒进行解答.
解答 解:将0.4mol/LNaHS溶液与0.2mol/LKOH溶液等体积混合,反应后溶质为0.05mol/L的Na2S,0.05mol/L的K2S和0.1mol/L的NaHS,
A.溶液中HS-、S2-发生水解,溶液呈碱性,则c(OH-)>c(H+),由于HS-的水解程度小于S2-,则c(HS-)>c(K+)>c(S2-),溶液中离子浓度大小为:c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+),故A正确;
B.由于HS-的水解程度大于电离程度,则溶液中HS-、S2-发生水解,溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.根据混合液中的电荷守恒可知:c(Na+)+c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-),由于c(Na+)=2c(K+),则3c(K+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故C错误;
D.根据C可知溶液中存在电荷守恒3c(K+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),溶液中存在物料守恒:c(S2-)+c(HS-)+c(H2S)=2c(K+),二者结合可得:2c(OH-)+c(S2-)=c(H+)+c(HS-)+3c(H2S),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意熟练掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用基础知识的能力.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
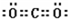 共价键;
共价键;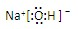 ,离子键,共价键;
,离子键,共价键;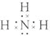 ,共价键;
,共价键;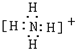 ,共价键.
,共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,则一定有SO42- | |
| C. | 用NaOH溶液能鉴别Mg( NO3)2、Cu( NO3)2和NaNO3三种溶液 | |
| D. | 加入硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,一定有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解的产物是高级脂肪酸和丙三醇 | |
| B. | 油脂属于混合物 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 阴极发生还原反应,正极亦发生还原反应 | |
| C. | Cl2与碱溶液的反应,实质是HClO与OH-的反应 | |
| D. | 从氯水中分离出HClO,可加入CaCO3蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2为0.15mol/L | B. | Z为0.2mol/L | C. | X2为0.3mol/L | D. | Z为0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com