
分析 (1)根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数,据此判断杂质类型;
(2)根据价层电子对互斥理论确定分子空间构型,根据氨气与氯化氢反应的方程式类比书写联氨加入足量盐酸反应的化学方程式;
(3)分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断,如果等于8就达到8电子稳定结构;
(4)单键都是σ键,双键和三键中均只有一个σ键,其余的是π键;
(5)分子间有氢键的存在的分子,使熔沸点升高,据此解答.
解答 解:(1)CH4中C形成4个σ键,无孤电子对,为sp3杂化;二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,所以碳原子采取sp杂化;COCl2的结构为$\underset{\stackrel{\;}{\underset{\stackrel{\;}{Cl}}{\;}-}}{\;}\underset{\stackrel{\underset{O}{∥}}{C}}{\;}\underset{\stackrel{\;}{-\underset{\stackrel{\;}{Cl}}{\;}}}{\;}$,其价层电子对数为3,不含有孤电子对,中心原子以采取sp2杂化,CH2=CHCOOH分子中,每个碳原子杂化轨道数为3,所以采取sp2杂化,
故答案为:COCl2、CH2=CHCOOH;
(2)NH3分子中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,中心原子杂化类型分别为sp3,中心原子含有1个孤电子对,空间构型为三角锥,氨气与氯化氢气体化合反应生成氯化铵,NH3+HCl=NH4Cl,联氨(N2H4)可视为是NH3分子中的一个氢原子被(-NH2)取代所形成的物质,所以联氨加入足量盐酸反应的化学方程式为:N2H4+2HCl=N2H6Cl2,
故答案为:三角锥;N2H4+2HCl=N2H6Cl2;
(3)H2O、H2O2中的氢是2个电子;OF2中,O元素化合价为-2价,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,SCl2中,S元素位于第ⅥA族,则6+2=8,满足分子中所有原子都满足最外层8电子结构,两种分子中各原子均达到8电子结构,
故答案为:OF2、SCl2;
(4)反应N2H4(l)+2H2O2=N2(g)+4H2O(g)中,若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成1molN2,4molH2O,则形成σ键有9mol和形成π键有2mol,
故答案为:9;2;
(5)水分子中氧原子的电负性大,所以在水分子间存在氢键,氢键的存在使水分子沸点显著提高,而H2S没有氢键,所以H2O熔沸点都比H2S高,
故答案为:水分子间存在氢键.
点评 本题是对物质结构的考查,涉及杂化、空间构型、原子核外电子排布规律、化学键等,注意价层电子对互斥理论的熟练应用,为高频考点,题目难度中等.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
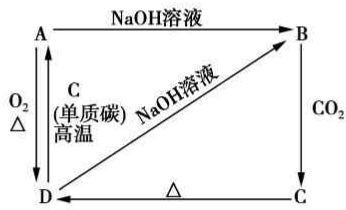 已知A是灰黑色、有金属光泽的固体单质,根据如图所示的组织之间的转化关系,回答下列有关问题
已知A是灰黑色、有金属光泽的固体单质,根据如图所示的组织之间的转化关系,回答下列有关问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了除去溴苯中的溴单质,用四氯化碳进行萃取、分液 | |
| B. | 乙烷与氯气物质的量之比1:1,光照可以制得纯净氯乙烷 | |
| C. | 将氯乙烷与氢氧化钠水溶液共热一段时间后,加入AgNO3溶液,产生沉淀,即证明氯乙烷中含有氯元素 | |
| D. | 为了除去乙烷中的乙烯气体,可将混合气体通过盛溴水的洗气瓶进行洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
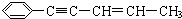 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | |
| B. | 该分子不存在顺反异构 | |
| C. | 所有碳原子可能在同一平面上 | |
| D. | 1 mol 该烃最多可与4 mol氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ①③⑥⑦ | C. | ②③④⑦ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的乙酸乙酯中含有18O | B. | 生成的水分子中不含18O | ||
| C. | 可能生成44g乙酸乙酯 | D. | 可能生成90g乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应时构成分子的原子种类发生改变 | |
| B. | 分子、原子、离子都是构成物质的微粒 | |
| C. | 不同元素最本质的区别在是相对原子质量不同 | |
| D. | 原子不显电性,是因为原子中不存在带电的粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com