

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
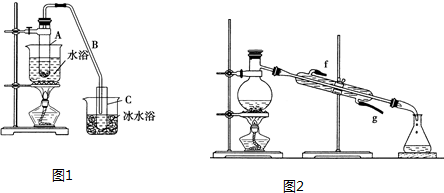
分析 (1)为醇的消去反应,浓硫酸作催化剂、脱水剂;冰水浴的目的是降低环己烯蒸气的温度,使其液化;
(2)环己烯粗品中含有环己醇和少量酸性杂质等,杂质与碳酸钠混合后与环己烯分层;
(3)将环己烯用图2装置进行蒸馏,需要温度计测定馏分的温度;加热蒸馏前要先加入生石灰能与水反应生成氢氧化钙,能除去水分;
(4)混合物没有固定的沸点,而纯净物有固定的沸点;醇与Na反应生成氢气,而烯烃不能,以此来解答.
解答 解:(1)由 可知,A中浓硫酸的作用是催化剂、脱水剂,将试管A置于水浴中的目的是冷却,防止环己烯挥发,
可知,A中浓硫酸的作用是催化剂、脱水剂,将试管A置于水浴中的目的是冷却,防止环己烯挥发,
故答案为:催化剂、脱水剂;冷却,防止环己烯挥发;
(2)环己烯粗品中含有环己醇和少量酸性杂质等.加入碳酸钠溶液洗涤,振荡、静置、分液,得到环己烯,烯烃与高锰酸钾反应,杂质与稀硫酸不反应,只有c符合,
故答案为:c;
(3)将环己烯用图2装置进行蒸馏,该装置中还缺少的玻璃仪器是温度计,加热蒸馏前要先加入生石灰的目的是除去水,得到纯净的环己烯,
故答案为:温度计;除去水;
(4)a.烯烃、醇均能被酸性高锰酸钾溶液氧化,不能区分,故不选;
b.醇与Na反应生成气体,烯烃不能,则用金属钠可区分,故选;
c.混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,可判断产品的纯度,故选;
故答案为:bc.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验装置、实验技能为解答的关键,侧重分析与实验力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
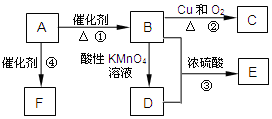 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,正反应速率增大、逆反应速率减小 | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X 的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 | |
| D. | 前2 min 内,用Y 的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
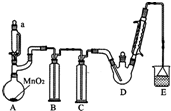 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
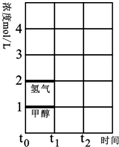 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ②③⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com