
【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)已知FeCl3在反应中得到电子,则该反应的还原剂是__________。
(2)将上述反应设计成的原电池如图所示,请回答下列问题:
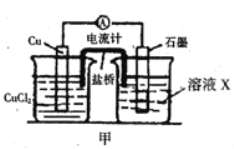
①电解质溶液X是_____;
②Cu电极上发生的电极反应式为_____;
③原电池工作时,盐桥中的___离子(填“K+”或“Cl—”)不断进入X溶液中。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )
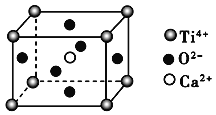
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:

(1)写出铜和浓硫酸反应的化学方程式:_____________。
(2)装置D中试管口放置的棉花中浸有NaOH溶液,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是__,B中应放置的液体是____(填序号)。
A.水 B.酸性KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
(4)取一定质量的铜片和一定体积浓度为18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中铜和硫酸都有剩余。若想使烧瓶中剩余的铜片溶解,可向烧瓶中加入下列试剂中的____(填序号)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数10亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:

用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59 ℃,沸点为 11 ℃,浓度过高时易发生分解,甚至爆炸。二氧化氯具有强刺激性和腐蚀性。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如图所示:
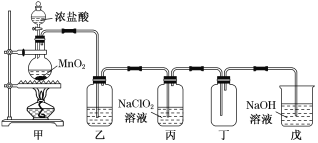
(1)甲装置中圆底烧瓶内发生反应的化学方程式是______________________________________。
(2)Cl-存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_____________________________________________。
(3)丙装置中发生的反应为:Cl2+2NaClO2===2ClO2↑+2NaCl 。
下列有关该实验的说法正确的是________________
A. 可用微热法检查实验装置的气密性
B. 如果乙装置是盛有浓硫酸,更有利于实验安全
C. 若甲中足量MnO2与含0.4 molHCl的浓盐酸反应,则丙中可制得0.2molClO2
D. 实验过程甲装置要缓缓加热,不宜强热
(4)戊装置烧杯中NaOH 溶液,其作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com