
分析 H2在反应中被氧化,应从负极通入,又因为是KOH溶液,不可能生成H+,负极反应为H2-2e-+2OH-=2H2O,正极反应为O2+2H2O+4e-=4OH-.
解答 解:H2在反应中被氧化,应从负极通入,又因为是KOH溶液,不可能生成H+,负极反应为H2-2e-+2OH-=2H2O,正极反应为O2+2H2O+4e-=4OH-;燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,所以氢氧根离子浓度减小,故答案为:O2+2H2O+4e-=4OH-;减小.
点评 本题考查原电池工作原理,难度不大,注意依据原电池的原理应用,首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应.


科目:高中化学 来源: 题型:选择题
| A. | 水分子的结构式是H-Cl-O | |
| B. | NaCl的电子式为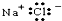 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为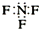 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法 | |
| B. | 乙炔、苯和乙苯的实验式相同 | |
| C. | 可用溴水鉴别乙醇、甲苯和溴苯 | |
| D. | 有机物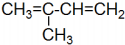 的系统命名为2-甲基-1,3-二丁烯 的系统命名为2-甲基-1,3-二丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陈醋 | B. | 食盐 | C. | 味精 | D. | 花生油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②中红色褪去的原因是SO2将SCN-还原 | |
| B. | ①中红色褪去的原因是KMnO4将SCN-氧化 | |
| C. | ②中红色褪去的原因是SO2将Fe3+还原成Fe2+ | |
| D. | SCN-在适当条件下可失去电子被氧化为(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | A与B的平衡转化率之比为1:2 | |
| D. | 第二次平衡时,C的浓度为0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com