
分析 100mL 1mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.1L=0.1mol,1.344L(标准状况)二氧化碳气体的物质的量为:$\frac{1.344L}{22.4L/mol}$=0.06mol,二者物质的量制备=0.1mol:0.06mol=5:3,说明反应生成碳酸钠和碳酸氢钠,据此写出反应的离子方程式;
据钠离子守恒、碳原子守恒列方程计算溶液中Na2CO3、NaHCO3的物质的量,进而计算CO32-和HCO3-的物质的量浓度之比.
解答 解:100mL 1mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.1L=0.1mol,1.344L(标准状况)二氧化碳气体的物质的量为:$\frac{1.344L}{22.4L/mol}$=0.06mol,二者物质的量制备=0.1mol:0.06mol=5:3,说明反应生成碳酸钠和碳酸氢钠,发生反应有:CO2+2OH-=CO32-+H2O、CO2+OH-=HCO3-;
设生成的Na2CO3、NaHCO3的物质的量分别为xmol、ymol,根据钠离子守恒、碳原子守恒,则:
$\left\{\begin{array}{l}{x+y=0.06}\\{2x+y=0.1}\end{array}\right.$,
解得:x=0.04mol,y=0.02mol,
则溶液中的CO32-和HCO3-的物质的量浓度之比为0.04mol:0.02mol=2:1,
答:发生反应的离子方程式为:CO2+2OH-=CO32-+H2O、CO2+OH-=HCO3-;所得CO32-和HCO3-的物质的量浓度之比为2:1.
点评 本题考查了化学方程式的计算,题目难度中等,根据反应过量情况正确判断反应产物为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明AgCl没有完全电离,AgCl是弱电解质 | |
| B. | 说明溶解的AgCl已完全电离,是强电解质 | |
| C. | 说明Ag+与Cl-反应不能完全进行到底 | |
| D. | 说明AgCl(s)与Ag+、Cl-共存,v溶解=v沉淀=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
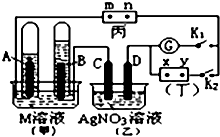 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用菜籽油浸泡花椒制得花椒油的过程未发生化学变化 | |
| B. | 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用 | |
| C. | 把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期 | |
| D. | 对医疗器械高温消毒时,病毒蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com