
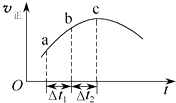
 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A、反应物的总能量低于生成物的总能量 |
| B、反应物浓度:a点小于b点 |
| C、△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D、反应在c点达到平衡状态 |


科目:高中化学 来源: 题型:
| 阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 | SO42-、OH-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
| OH- |
| H+ |
| OH- |
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com