
【题目】具有相同原子数和价电子数的微粒之间互称等电子体,等电子体往往具有相似的空间构型,以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. N2H4和C2H4 C. O3和SO2 D. CO2和N2O
科目:高中化学 来源: 题型:
【题目】对pH值相同的盐酸和醋酸两种溶液的说法正确的是
A. 中和碱的能力相同 B. 盐酸和醋酸的物质的量浓度相同
C. OH-的物质的量浓度相同 D. H+的物质的量浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知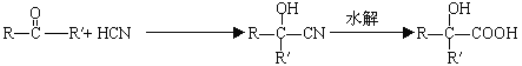 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)写出下列有机物的结构简式:
A___________________C _______________________E ____________________F_________________。
(2)写出下列有关反应的化学方程式:
C →D_______________________;
D →E_______________________;
E→F_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2,回答下列问题:
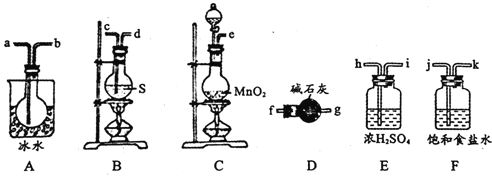
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为________。
(2)制取Cl2应选用的裝置是_______(填字母编号);反应的离子方程式为________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为____(按气流方向,用小写字母表示)。
(4)仪器D的名称是_______;D中碱石灰的作用是________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是____________
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式_________;该反应中被氧化和被还原的元素的质量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成是一个需要经历多步反应的过程,我们常用的塑料包装绳(主要成分为聚氯乙烯 ![]() 就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______,如果司机酒驾检查时该物质显示的颜色变化是_____________________。
(2)关于R单质晶体的说法正确的是______________。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:

已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________。
(4)W的原子半径为r,其晶体的空间利用率______________(用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______,中心原子的杂化方式为_____
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________个。
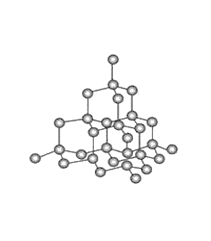
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com