
【题目】美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 .
【答案】NO2﹣和NH4+;H3O+和ClO3﹣;NO3﹣和CO32﹣;PO43﹣和SO42﹣ .
【解析】解:A、NO2﹣中心原子的价层电子对数=2+ ![]() (5+1﹣2×2)=3,含有一个孤电子对,空间构型为V形,NH4+中心原子的价层电子对数=4+
(5+1﹣2×2)=3,含有一个孤电子对,空间构型为V形,NH4+中心原子的价层电子对数=4+ ![]() (5﹣1﹣4×1)=4,没有孤电子对,空间构型为正四面体,故A不选;
(5﹣1﹣4×1)=4,没有孤电子对,空间构型为正四面体,故A不选;
B、H3O+中心原子的价层电子对数=3+ ![]() (6﹣1﹣3×1)=4,含有一个孤电子对,空间构型为三角锥形,ClO3﹣中心原子的价层电子对数=3+
(6﹣1﹣3×1)=4,含有一个孤电子对,空间构型为三角锥形,ClO3﹣中心原子的价层电子对数=3+ ![]() (7+1﹣3×2)=4,含有一个孤电子对,空间构型为三角锥形,故B不选;
(7+1﹣3×2)=4,含有一个孤电子对,空间构型为三角锥形,故B不选;
C、NO3﹣中心原子的价层电子对数=3+ ![]() (5+1﹣3×2)=3,没有孤电子对,空间构型为平面三角形,CO32﹣中心原子的价层电子对数=3+
(5+1﹣3×2)=3,没有孤电子对,空间构型为平面三角形,CO32﹣中心原子的价层电子对数=3+ ![]() (4+2﹣2×3)=3,没有孤电子对,空间构型为平面三角形,故C选;
(4+2﹣2×3)=3,没有孤电子对,空间构型为平面三角形,故C选;
D、PO43﹣中心原子的价层电子对数=4+ ![]() (5+3﹣4×2)=4,没有孤电子对,空间构型为正四面体,SO42﹣中心原子的价层电子对数=4+
(5+3﹣4×2)=4,没有孤电子对,空间构型为正四面体,SO42﹣中心原子的价层电子对数=4+ ![]() (6+2﹣4×2)=4,没有孤电子对,空间构型为正四面体,故D不选.
(6+2﹣4×2)=4,没有孤电子对,空间构型为正四面体,故D不选.
故选C.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有关仪器用途的说法正确的是 ( )
A. 试管、烧杯均可用于给液体、固体加热
B. 使食盐水中NaCl结晶析出时,用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
C. 区别NaCl、Na2SO4时常用到胶头滴管、试管
D. 漏斗不可用于过滤溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定.工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 .
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅.一种合成氮化硅的工艺主要流程如图: 
①净化N2和H2时,铜屑的作用是:;硅胶的作用是 .
②在氮化炉中3SiO2(s)+2N2(g)═Si3N4(s)△H=﹣727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度;体系中要通入适量的氢气是为了 .
③X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”).
(3)工业上可以通过如图所示的流程制取纯硅:
①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式 .
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和CO是合成许多有机物的原料,有如下反应:mH2+nCO==wX(反应条件已省去,m、n、w为化学计量数)。如m:n=l:1且w=l,则有机物X可能是①HCHO②C2H5OH ③CH3COOH ④CH3CHO 中的
A. ①和② B. ①和③ C. ②和③ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是( )
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH ![]() Na2SiO3+H2O
Na2SiO3+H2O
B.在海带灰的浸出液(含有I﹣)中滴加H2O2得到I2:2I﹣+H2O2+2H+═I2+O2↑+2H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵“(主要成分盐酸)混合使用放出氯气:ClO﹣+Cl﹣+2H+═Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年初天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2 . ①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
②吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:l | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显性(填“酸”、“碱”或“中”),用化学平衡原理解释: .
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: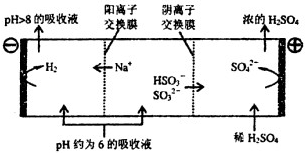
写出HSO3﹣在阳极放电的电极反应式: , 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJmol﹣1
若用标准状况下4.48L CH4还原NO2至N2 , 整个过程中转移的电子总数为(阿伏伽德罗常数的值用NA表示),放出的热量为kJ.
(3)工业上合成氮所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列电子排布式判断,处于激发态的原子是
A. 1s22s22p6B. 1s22s22p63s1C. 1s22s23s1D. [Ar]3d14s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com