
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | EGCG在空气中易氧化,也能与溴水发生加成反应 | |
| C. | 1molEGCG最多可与含9mol氢氧化钠的溶液完全作用 | |
| D. | EGCG能与碳酸钠溶液反应,但不能放出二氧化碳 |
分析 由EGCG的结构式可知,分子中含酚-OH、-COOC-、-COC-,结合苯酚、酯的性质来解答.
解答 解:A.EGCG的分子中含有22个C原子、18个H原子、11个O原子,分子式应为C22H18O11,故A正确;
B.不含碳碳双键,与溴水不发生加成反应,故B错误;
C.酚羟基可与NaOH反应,-COO-在碱性条件下水解生成-COONa,1mol EGCG最多能与含9mol氢氧化钠的溶液发生反应,故C正确;
D.含有酚羟基,酸性不碳酸弱,与碳酸钠反应生成碳酸氢钠,故D正确.
故选B.
点评 本题考查有机物的结构和性质,题目难度中等,注意把握常见有机物的官能团的性质,本题易错点为有机物的分子式,注意观察.


科目:高中化学 来源: 题型:选择题
| A. | Kw变大、pH变小、呈酸性 | B. | Kw变大、pH不变、呈中性 | ||
| C. | Kw变小、pH变大、呈碱性 | D. | Kw变大、pH变小、呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
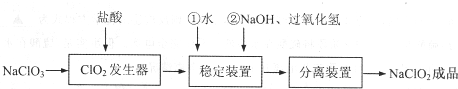
| 步骤Ⅰ | 称取NaClO2样品Wg,加水配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol•L-1的 Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中混有的苯酚可加入浓溴水后过滤 | |
| B. | 向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应 | |
| C. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 | |
| D. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使溴的四氯化碳溶液褪色 | |
| B. | 与银氨溶液反应析出银 | |
| C. | 与新制Cu(OH)2反应 | |
| D. | 与乙醇在浓硫酸催化下发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/L HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中,Ksp(CaF2)=$\frac{1}{{K}_{a}HF}$ | |
| D. | 该体系中有CaF2沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等浓度的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com