
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓H2SO4 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
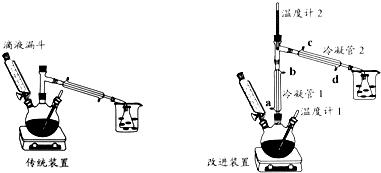
分析 (1)根据浓硫酸的稀释操作进行解答;
(2)改进装置提高乙醇的利用率,冷凝管1冷却乙醇,不冷却乙醚,冷凝管2冷却乙醚,乙醇的沸点高于乙醚,则冷凝管1中的温度较高,冷凝管2中的温度较低,结合采取逆流原理通入冷凝水,使冷凝管充满冷凝水,充分冷却;
(3)温度计2的读数比预计温度高,可能有乙醇蒸出,冷凝水未能充分冷却,应加快冷凝管中水的流速;
(4)传统装置中乙醇被蒸出;
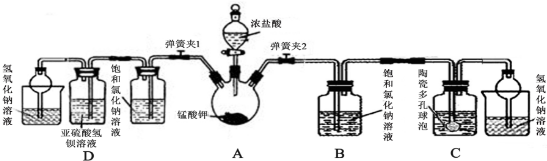
(5)粗产品洗涤后需要进行分液分离;
(6)会反应副反应生成二氧化硫、二氧化碳,用NaOH溶液时为了除去二氧化硫、二氧化碳,然后饱和NaCl溶液洗涤NaOH,以免跟CaCl2产生沉淀,可以降低乙醚的溶解度.
解答 解:(1)向三颈瓶A加乙醇和浓硫酸的顺序为:先加入乙醇,再慢慢倒入浓硫酸,边倒边搅拌,
故答案为:乙醇;浓硫酸;
(2)改进装置提高乙醇的利用率,冷凝管1冷却乙醇,不冷却乙醚,冷凝管2冷却乙醚,乙醇的沸点高于乙醚,则冷凝管1中的温度较高,冷凝管2中的温度较低,结合采取逆流原理通入冷凝水,使冷凝管充满冷凝水,充分冷却,水流方向为d→c→a→b,
故选:B;
(3)温度计2的读数比预计温度高,可能有乙醇蒸出,冷凝水未能充分冷却,应加快冷凝管中水的流速,
故选:D;
(4)传统装置中乙醇被大量蒸出,降低了产率,
故答案为:传统装置中乙醇被大量蒸出,降低了产率;
(5)粗产品洗涤后需要进行分液分离,仪器A为分液漏斗,
故答案为:分液漏斗;
(6)会反应副反应生成二氧化硫、二氧化碳,用NaOH溶液时为了除去二氧化硫、二氧化碳,用饱和氯化钠水溶液洗涤,以免跟CaCl2产生沉淀,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度.
故答案为:除去二氧化硫、二氧化碳;饱和NaCl溶液.
点评 本题考查有机物的制备实验,涉及对装置与原理的分析评价、物质的分离提纯等,是对基础知识的综合考查,需要学生具备扎实的基础与分析处理问题的能力.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 22.20 |
| 第二次 | 20.00 | 1.56 | 25.50 |
| 第三次 | 20.00 | 0.22 | 22.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
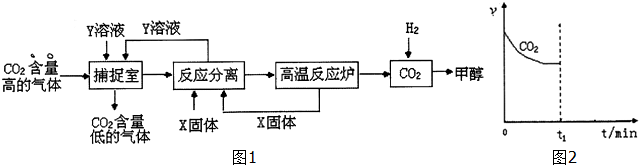
科目:高中化学 来源: 题型:推断题
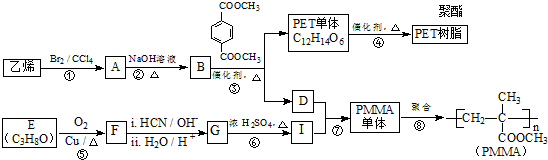
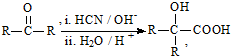 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.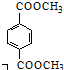 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH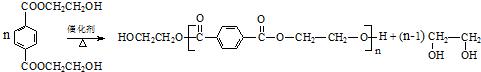 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的熔点一般比组分金属高 | B. | 合金中只含金属元素 | ||
| C. | 合金的机械性能一般比组分金属好 | D. | 合金的硬度一般比组分小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时生成的气体是氧气 | |
| B. | 氧化剂是氢氧化钠和水 | |
| C. | 当产生1.5mol气体时电子转移3NA个 | |
| D. | 这个反应体现了金属的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com