
| 糖类 | 油脂 | 蛋白质 | 其他 | |
| 花生米 | 24% | 39% | 26% | 11% |
| 小麦 | 76% | 2% | 11% | 11% |
分析 (1)由质量与表格中含量及能量的乘积之和计算能量;
(2)约有85%的油脂可成为商品花生油,结合花生米含油脂为39%计算.
解答 解:(1)500 g小麦的能量为500 g×(0.76×17.2+0.02×39.3+0.11×18)kJ•g-1=7 919 kJ;
500 g花生米的能量为500 g×(0.24×17.2+0.39×39.3+0.26×18)kJ•g-1=12 067.5 kJ,
则等质量时花生米的能量大,
答:500g花生米的能量大;
(2)花生米含油脂为39%,则100 t花生可轧油为100 t×0.39×0.85=33.15 t,
答:可生产33.15吨商品花生油.
点评 本题考查能量的计算,为高频考点,把握表格数据的应用、能量计算方法为解答的关键,侧重分析与计算能力的考查,注意能量转化方式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | [Co(NH3)4 Cl2]Cl | B. | [Co(NH3)6]Cl3 | C. | [Cu(NH3)4]Cl2 | D. | [Co(NH3)3 Cl3] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④②③① | D. | ①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
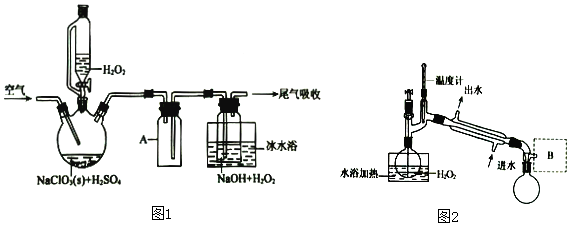
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
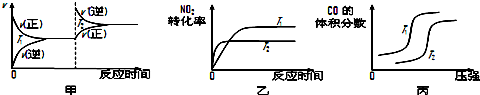
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
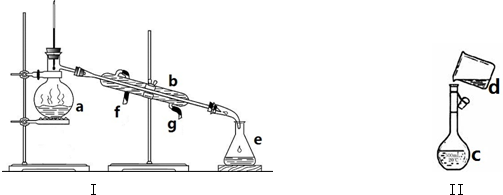
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯 | B. | 环丁二烯 | C. | 2-丁炔 | D. | 1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com