
| A. | 原子半径:Si>Mg | B. | 氢元素不存在同位素 | ||
| C. | 该反应熵增 | D. | SiH4比HCl稳定 |
科目:高中化学 来源: 题型:解答题
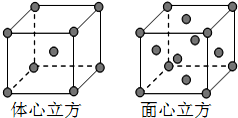 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应/K/温度 | 458K 478K 488K |
| ① ② ③ | 1.78×104 1.43×104 1.29×104 1.91×107 1.58×107 1.45×107 8.11×108 3.12×108 2.00×108 |
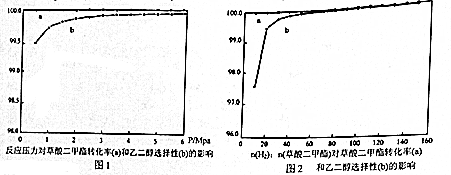
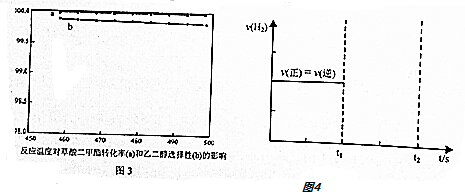
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量ZnCl2固体 | B. | 加入少量CuSO4固体 | ||
| C. | 加入少量水 | D. | 用98%的浓硫酸代替稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验操作示意图 | 实验现象 |
| Ⅰ | 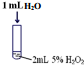 | 有极少量气泡产生 |
| Ⅱ | 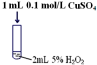 | 产生气泡速率略有加快 |
| Ⅲ | 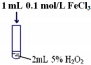 | 产生气泡速率明显加快 |
| t/min | 0 | 2 | 3 | 6 | 8 | 10 |
| v(O2)mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
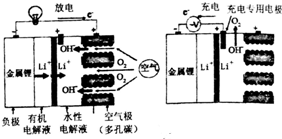
| A. | 充电时,锂离子向阴极移动 | |
| B. | 充电时阴极电极反应式为:Li++e-═Li | |
| C. | 放电时正极电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 负极区的有机电解液可以换成水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 mol | B. | 3.6 mol | C. | 100 mol | D. | 200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com