
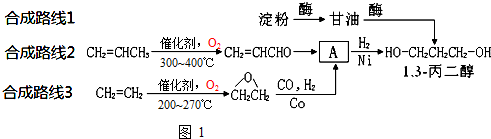
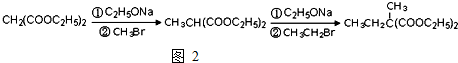
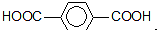
 为原料可以合成聚酯PTT,写出其化学方程式
为原料可以合成聚酯PTT,写出其化学方程式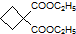 ,再转化为
,再转化为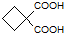 .
.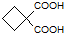 的同分异构体不可能属于
的同分异构体不可能属于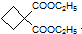 ,必须先合成哪些物质?(用合成该物质的化学方程式回答)
,必须先合成哪些物质?(用合成该物质的化学方程式回答)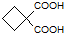 的不饱和度为3,酚类含有苯环,其不饱和度最少为4,故其同分异构体不可能为酚类;
的不饱和度为3,酚类含有苯环,其不饱和度最少为4,故其同分异构体不可能为酚类; ,
, ;
;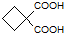 的同分异构体可以为含有-OH,属于醇,可以含有-CHO,属于醛,可以为酯类.
的同分异构体可以为含有-OH,属于醇,可以含有-CHO,属于醛,可以为酯类.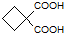 的吧饱和度为3,酚类含有苯环,其不饱和度最少为4,故其同分异构体不可能为酚类,
的吧饱和度为3,酚类含有苯环,其不饱和度最少为4,故其同分异构体不可能为酚类,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、变深 | B、变浅 |
| C、不变 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
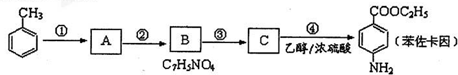
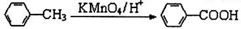
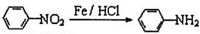 (有若碱性,易被氧化)
(有若碱性,易被氧化)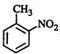 、
、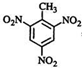 等
等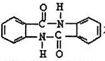 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图| 浓H2SO4 |
| 170℃ |
| Br2 |
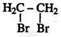 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
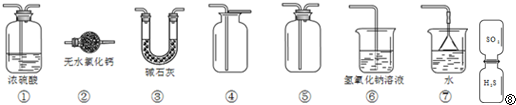
| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
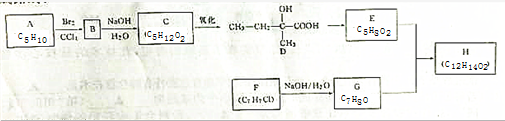
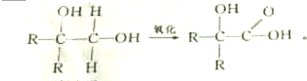
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com