
| A、吸热反应一定不能自发进行 |
| B、△H大于零的反应是放热反应 |
| C、已知S(单斜,s)=S(正交,s)△H<0,则单斜硫比正交硫稳定 |
| D、应用盖斯定律,可计算某些难以直接测量的反应的反应热 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、Na2O |
| C、Na2S |
| D、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
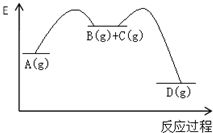 对于如下反应,其反应过程的能量变化示意图如图:
对于如下反应,其反应过程的能量变化示意图如图:| 编号 | 反应 | 平衡常数 | 反应热 |
| 反应① | A(g)=B(g)+C(g) | K1 | △H1 |
| 反应② | B(g)+C(g)=D(g) | K2 | △H2 |
| 反应③ | A(g)=D(g) | K3 | △H3 |
| A、K3=K1+K2 |
| B、△H3=△H1+△H2 |
| C、加催化剂,反应①的反应热降低,反应速率加快 |
| D、则增大压强,K1减小,K2增大,K3不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A、温度:T1>T2>T3 |
| B、正反应速率:υ(a)>υ(c) υ(b)>υ(d) |
| C、平衡常数:K(a)>K(c) K(b)=K(d) |
| D、平均摩尔质量:M(a)<M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
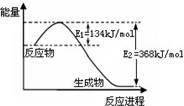
| A、已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=+234 kJ?mol-1 |
| B、氯化铵溶液中加入足量的过氧化钠,仅产生一种气体 |
| C、25℃时,0.10 mol?L-1 NaHCO3溶液,加水稀释后,c(H+)与c(OH-)的乘积变小 |
| D、常温下,反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A的氧化物常温下一般均为无色无味气体 |
| B、元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
| C、原子半径:C>D>B |
| D、元素B的气态氢化物的沸点比元素E气态氢化物的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠 食盐 NaCl2 |
| B、碳酸氢钠 纯碱 NaHCO3 |
| C、氢氧化钙 熟石灰 CaO |
| D、氢氧化钠 烧碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C% | H% | O% |
| 40.00% | 6.67% | 53.33% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com