
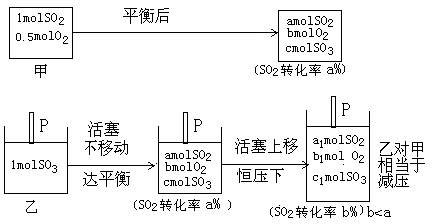
| A、平衡时,容器内的压强:甲>乙 |
| B、反应达到平衡所需要的时间:甲<乙 |
| C、平衡时,氧气的浓度:甲<乙 |
| D、平衡时,容器内SO3的体积分数:甲>乙 |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
| A、①④⑤ |
| B、①②⑥⑦ |
| C、①③④⑤⑦ |
| D、全部都不能带上车 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、K+、SO42-、Cl-、AlO2- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
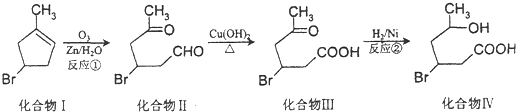
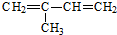 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是为查看答案和解析>>
科目:高中化学 来源: 题型:
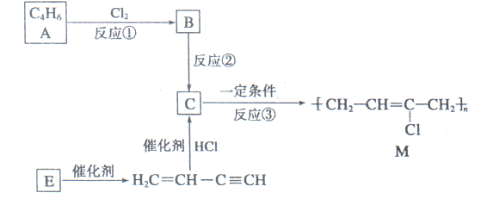
| 反应④ |
| 反应⑤ |
| 反应⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com