
| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
分析 利用金属单质之间的置换反应、失去电子的难易程度、金属对应阳离子的氧化性、与水或酸反应的难易程度、金属的最高价氧化物对应水化物的碱性等来比较金属性的强弱.
解答 解:A、Na能与冷水反应,而Al不能,说明金属钠的活泼性强于金属镁,故A正确;
B、元素最高价氧化物对应水化物的碱的溶解性,不能证明金属的活泼性强弱,故B错误;
C、等物质的量的NaOH和Al(OH)3可以电离出氢氧根离子的数目不能证明金属的活泼性强弱,可以根据电离出氢氧根离子的难易判断,故C错误;
D、原子失电子的多少不能证明金属的活泼性强弱,可以根据原子失电子的难易来判断,故D错误.
故选A.
点评 本题考查元素金属性的强弱比较方法,明确常见的金属性比较的方法即可解答,难度中等.


科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应都不需要加热 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
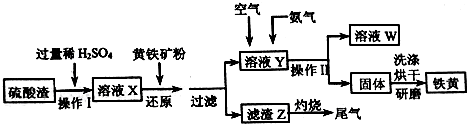
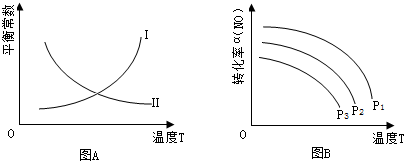
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
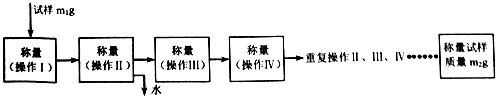
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有OH- | B. | 与氯化铵溶液反应放出氨气 | ||
| C. | 与金属铝反应放出氢气 | D. | 滴入甲基橙试液后,溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:24 | D. | 24:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 由元素X和Q组成的化合物不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物对应水化物可彼此反应 | |
| C. | Y-半径比Q2-半径大 | |
| D. | M(OH)2的碱性比XOH的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
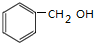
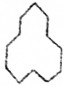 名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com