
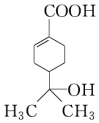
| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 该有机物的分子式为C10H16O3 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
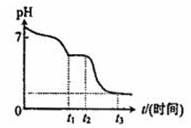
| 编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径大小顺序为:W>Z>R | |
| B. | X2Z2的电子式为: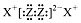 | |
| C. | X2Z的沸点比X2W的沸点高 | |
| D. | Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤水点豆腐、明矾净水的原理都是破坏胶体的介稳性 | |
| B. | 铁、铝、铜制容器放置空气中都能在表面形成致密氧化物 | |
| C. | 单晶Ge是半导体,可以作为光电转换材料用于太阳能电池 | |
| D. | 检测酒后驾车者呼出气中的乙醇属于化学检测方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
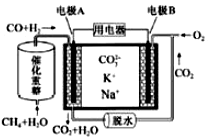
| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol 电子 | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com