
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
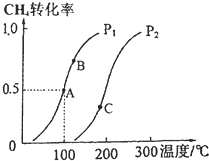 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其基态原子有7种能量不同的电子;
.其基态原子有7种能量不同的电子;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
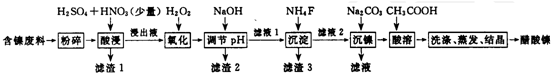
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaS04 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
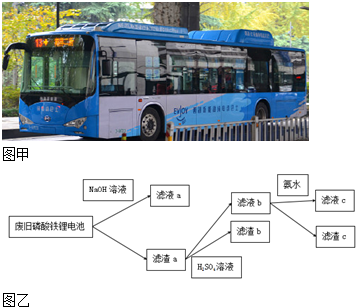
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛. ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝.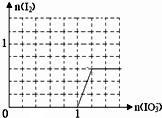 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com